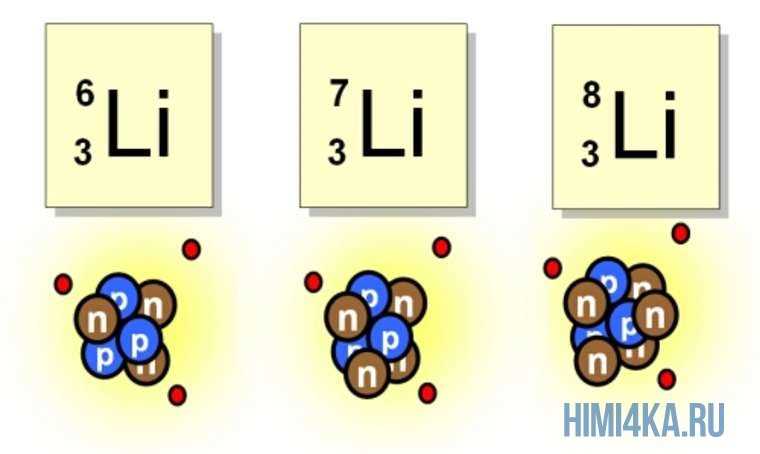
Что такое изотопы?
Изотопы обладают свойствами, сходными с основным элементом, но могут иметь различия в массе и стабильности. Некоторые изотопы более стабильны, в то время как другие могут быть радиоактивными и распадаться со временем.
Например, углерод имеет несколько изотопов, самым распространенным из которых является углерод-12. Однако существуют и другие изотопы углерода, такие как углерод-13 и углерод-14, которые отличаются по числу нейтронов в атомном ядре. Углерод-14, например, является радиоактивным изотопом, используемым в радиоуглеродной датировке для определения возраста археологических находок.
Изотопы могут быть полезными в научных исследованиях и применяются в различных областях, таких как археология, медицина и энергетика. Например, изотопы используются для создания радионуклидных источников, применяемых в медицине для диагностики и лечения. Они также являются важными инструментами для исследования процессов ядерного распада и определения возраста углеродсодержащих материалов.
Исследование изотопов позволяет нам лучше понять природу и состав веществ, проводить анализ материалов и решать различные задачи. Понимание изотопов помогает расширить наши знания о мире вокруг нас и применить их для блага человечества.
Основные характеристики изотопов
Во-первых, каждый изотоп имеет свойственную ему атомную массу. Атомная масса — это сумма протонов и нейтронов в ядре атома. Например, углерод может иметь несколько изотопов, но углерод-12 имеет атомную массу 12 атомных единиц, углерод-13 — 13 атомных единиц, а углерод-14 — 14 атомных единиц.
Во-вторых, изотопы имеют различные стабильности. Некоторые изотопы стабильны и не подвержены распаду, в то время как другие могут быть радиоактивными и иметь способность распадаться со временем. Радиоактивные изотопы испускают радиацию, что делает их полезными в медицине и археологии. Они могут быть использованы, например, для диагностики и лечения различных заболеваний.
Третья характеристика изотопов — их распространенность. Некоторые изотопы встречаются в природе гораздо чаще, чем другие. Например, изотоп углерода-12 является наиболее распространенным в природе, составляя около 98,9% всех атомов углерода. Более редкими являются, например, углерод-13 и углерод-14.
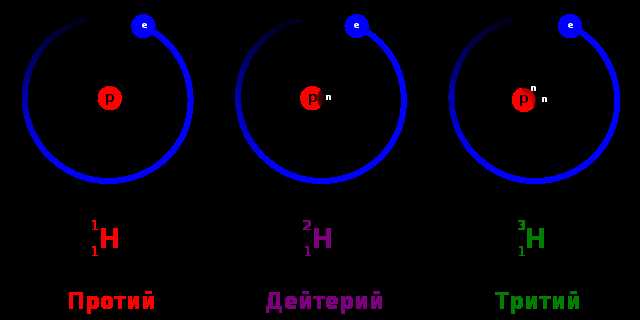
Кроме того, изотопы могут обладать различными химическими свойствами. Они могут иметь разные реакционную способность и скорость реакций. Например, водород состоит из трех изотопов: протия, дейтерия и трития. Каждый из них имеет разные свойства и может использоваться в различных химических реакциях.
Наконец, изотопы могут быть использованы для определения возраста или происхождения различных материалов. Например, метод радиоуглеродного датирования использует изотоп углерода-14 для определения возраста органических материалов, таких как древесина или кости.
Массовое число и атомное число
Когда мы говорим о химических элементах, мы часто сталкиваемся с такими понятиями, как массовое число и атомное число. Эти числа имеют важное значение в понимании структуры атомов и изотопов.
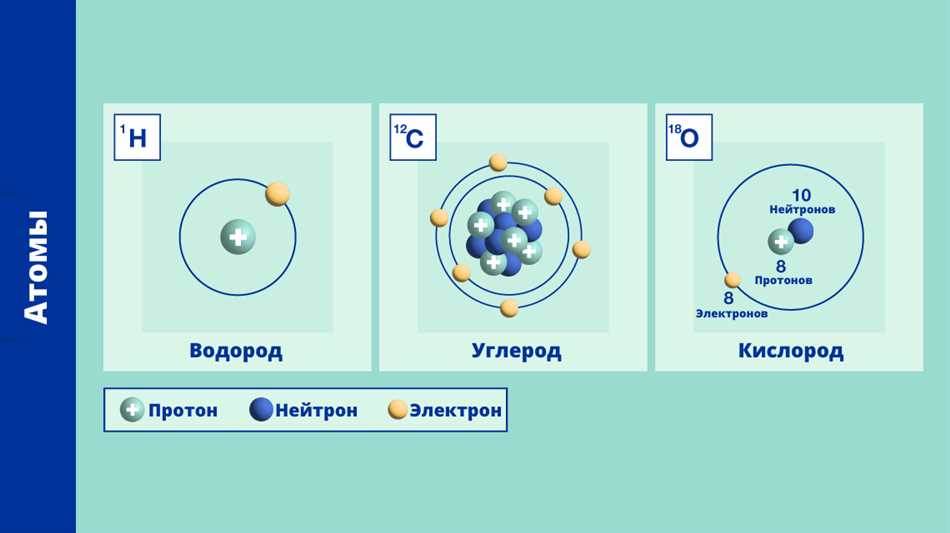
Атомное число представляет собой количество протонов в атоме. Каждый химический элемент имеет уникальное атомное число, которое определяет его место в периодической таблице. Например, атомное число углерода равно 6, а у кислорода — 8. Атомное число определяет химические свойства элемента и его положение в периодической системе элементов.
Атомное число также определяет количество электронов в нейтральном атоме. Каждый атом стремится иметь равное количество протонов и электронов, чтобы быть электрически нейтральным.
Массовое число, с другой стороны, представляет собой сумму протонов и нейтронов в атоме. Нейтроны — это нейтральные частицы, которые также находятся в ядре атома. Обычно массовое число округляется до ближайшего целого числа. Например, углерод имеет массовое число 12, а кислород — 16.
Массовое число играет важную роль в определении изотопов. Изотопы — это атомы одного и того же элемента, у которых разное количество нейтронов. Например, изотопы углерода 12 и углерода 14 имеют одинаковое атомное число (6), но различное массовое число (12 и 14 соответственно).
Знание массового числа и атомного числа позволяет нам определить число нейтронов в атоме, зная только атомное число и массовое число. Для этого нужно вычесть атомное число из массового числа.
Например, для углерода с атомным числом 6 и массовым числом 12, мы можем определить число нейтронов, вычитая 6 из 12: 12 — 6 = 6. Таким образом, углерод имеет 6 нейтронов в своем ядре.
Массовое число и атомное число являются важными концепциями в химии, которые помогают нам лучше понять структуру атомов и изотопов. Знание этих чисел позволяет нам классифицировать элементы, анализировать их свойства и понимать их взаимодействие в химических реакциях.
Символы изотопов
Символ изотопа обычно записывается в виде A-Z, где A — число нуклонов (протонов и нейтронов) в ядре, а Z — атомный номер элемента. Например, изотоп углерода с 6 нейтронами в ядре обозначается как С-12, а изотоп углерода с 7 нейтронами — С-13.
В модерной периодической системе элементов существует много изотопов разных элементов, и каждый из них имеет свой символ. Некоторые изотопы имеют так называемые собственные имена, например, изотоп водорода с 1 протоном и 0 нейтронов в ядре называется дейтерием и обозначается как H-2. Изотоп водорода с 1 протоном и 1 нейтроном в ядре называется тритием и обозначается как H-3.
Символы изотопов обычно используются в химических и физических исследованиях для обозначения конкретных типов атомов. Знание символов изотопов позволяет химикам и физикам понять, какие именно изотопы они изучают или используют в своих экспериментах.
Таким образом, символы изотопов представляют собой уникальные обозначения для каждого изотопа элемента и позволяют ученым точно определять и идентифицировать атомы, с которыми они работают.
Как образуются изотопы?
Итак, как образуются изотопы? Ответ кроется в процессе ядерного образования элементов, известном как ядерная реакция. На самом деле, изотопы образуются естественным образом при реакциях внутри звезд и в результате высокоэнергетического события, такого как взрыв суперновой.
Но все начинается с процесса нуклеосинтеза, где происходит слияние атомных ядер и образуются новые элементы. В течение длительного времени происходит нуклеосинтез в звездах, где элементы, такие как водород и гелий, превращаются в более тяжелые элементы, такие как углерод, кислород и железо.
При этом процессе в ядре атома происходят различные реакции. Иногда ядро может захватить один или несколько дополнительных нейтронов, что приводит к образованию изотопов. Нейтроны — это нейтральные частицы в атомном ядре, и их количество может варьироваться в разных изотопах.
Таким образом, изотопы образуются в результате ядерных реакций, где атомы претерпевают изменения в своих ядрах. Этот процесс является естественным и происходит во Вселенной уже много миллиардов лет.
И еще любопытный факт! Изотопы могут иметь различные свойства, такие как радиоактивность или стабильность. Некоторые изотопы могут быть полезны для медицинских и научных исследований, а другие могут быть опасными из-за их радиоактивности.
Так что теперь вы знаете, как образуются изотопы. Они являются фундаментальными строительными блоками всего материального мира и играют важную роль в нашем понимании вселенной. Удивительно, не правда ли?
Радиоактивные изотопы

О, радиоактивные изотопы, как интересно! Не знаешь, что это такое? Представь себе маленькие «частицы» внутри атома, называемые нейтронами и протонами. Обычно они находятся в ядре атома в устойчивом состоянии, но в случае радиоактивных изотопов, один или несколько нейтронов в ядре слишком много или слишком мало. Это создает дисбаланс и делает ядро нестабильным.
Знаешь, что самое интересное? Когда ядро нестабильно, оно стремится достигнуть более устойчивого состояния. И как оно это делает? Ядро испускает радиацию в процессе распада. Это может быть энергия, которую мы не видим, или даже частицы, которые мы называем альфа- и бета-частицами. Они просто вылетают из ядра и идут куда-то в пространство, и я представляю, что они весело взволнованы исследуют мир вокруг!
Давай поближе посмотрим на примеры радиоактивных изотопов. Один из наиболее известных примеров — уран-235. Ну конечно, ты слышал о ядерном делении, не так ли? Вот эта маленькая «партия» урана-235 может испускать радиацию и в конечном итоге превращаться в другие элементы. Еще один интересный пример — радий-226. Этот изотоп может быть очень полезным для лечения раковых заболеваний, но он также является радиоактивным и испускает радиацию в процессе распада.
Кстати, интересно знать, что радиоактивные изотопы могут иметь различные периоды полураспада. Что это значит? Допустим, мы взяли один литр радиоактивного вещества и оставили его в покое. За определенное время, которое мы называем периодом полураспада, только половина вещества останется неизменной, а другая половина превратится в другой элемент. К потенциально опасным радиоактивным изотопам относится плутоний-239, который имеет очень долгий период полураспада — около 24 000 лет. Уух, как много времени, не так ли?
Теперь, когда мы знаем немного больше о радиоактивных изотопах, давай зададим себе вопрос: «Зачем нам все это нужно?». Ну, радиоактивные изотопы имеют множество практических применений. Например, они используются в медицине для диагностики и лечения заболеваний, в промышленности для измерения уровня загрязнения окружающей среды, и даже в археологии для определения возраста артефактов.
Вот оно, увлекательное мир радиоактивных изотопов! Кто бы мог подумать, что толстенькие атомы скрывают в себе такую занимательную тайну? Продолжай искать новые знания о химии, и кто знает, может быть ты сможешь сделать свою собственную открытие в этой увлекательной области!
Стабильные изотопы
Ты знаешь, что атомы стремятся быть стабильными и иметь равное количество протонов и нейтронов в ядре? Но иногда бывает, что атомы имеют превышение или недостаток нейтронов. И вот тогда происходит распад изотопов. Но не со стабильными изотопами! Они остаются стабильными на протяжении всей своей жизни.
Давай посмотрим на примеры стабильных изотопов. Например, углерод. В природе ты найдешь два стабильных изотопа углерода — С-12 и С-13. С-12 самый распространенный изотоп углерода, а вот С-13 выпадает реже. Еще пример — кислород. Тут уже три стабильных изотопа — O-16, O-17 и O-18. И таких примеров можно найти еще много!
Да любой элемент может иметь несколько стабильных изотопов. Все зависит от количества протонов и нейтронов в его ядре. Интересно, правда?
Стабильные изотопы имеют множество применений в науке. Например, они могут использоваться для определения возраста горных пород или артефактов с помощью радиоактивного датирования. Также стабильные изотопы могут служить индикаторами химических реакций и процессов. В медицине они используются для создания трассировщиков, которые помогают диагностировать и лечить различные заболевания.
Конечно, стабильные изотопы — это всего лишь малая часть от всего многообразия изотопов, которые существуют в природе. Но они играют важную роль в нашей жизни и помогают нам лучше понять химию и физику мира вокруг нас.
Так что изучение стабильных изотопов — это увлекательное и познавательное занятие! Приятно, что ты интересуешься химией и задаешь вопросы. А какие темы в химии еще вызывают у тебя интерес? Напиши мне, и мы сможем исследовать их вместе!
Изотопы в химии: определение, примеры, класс 8

Примеры изотопов:
- Углерод — углерод-12, углерод-13, углерод-14. Углерод-12 является наиболее распространенным изотопом углерода.
- Кислород — кислород-16, кислород-17, кислород-18. Кислород-16 является наиболее распространенным изотопом кислорода.
- Водород — водород-1, водород-2, водород-3. Водород-1 является наиболее распространенным изотопом водорода.
Изотопы могут использоваться в различных областях, например:
- Археология — с помощью изотопов археологи могут определять происхождение древних материалов.
- Медицина — радиоактивные изотопы используются для диагностики и лечения различных заболеваний.
- Энергетика — некоторые изотопы могут использоваться в ядерной энергетике.
Важно помнить, что изотопы могут иметь разные степени радиоактивности, поэтому их использование требует осторожности и специальных мер предосторожности.