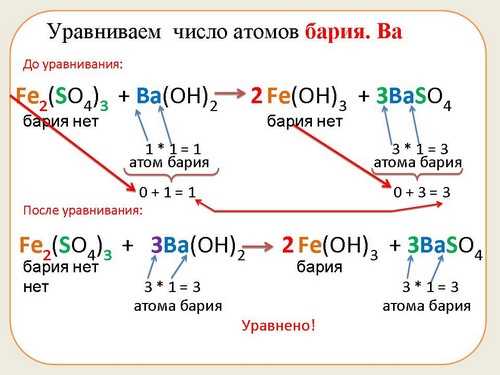
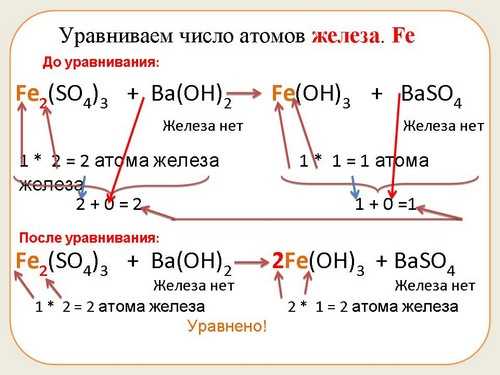
Коэффициенты играют важную роль в химии, помогая нам понять и описать химические реакции. Но что это такое и как они работают? Коэффициент — это число, которое указывает на количество молекул или атомов вещества, участвующего в реакции. Они помогают сбалансировать уравнение реакции, чтобы количество атомов каждого элемента до и после реакции было одинаковым.
Принцип работы коэффициентов основан на законе сохранения массы: масса химических реагентов должна быть равна массе продуктов реакции. Коэффициенты могут быть изменены, чтобы соблюсти этот принцип.
Что такое коэффициент в химии?
Коэффициент представляет собой число, которое ставится перед формулой химического вещества или группой веществ. Например, в уравнении реакции H2O + CO2 -> C6H12O6 + O2, коэффициенты 1, 1, 6 и 6 соответственно указывают на количество каждого вещества, участвующего в реакции.
С помощью коэффициентов можно обратить внимание на множество интересных и важных аспектов в химии. Например, они позволяют определить соотношение, в котором реагенты вступают в реакцию, и продукты, которые образуются в результате этой реакции.
Коэффициенты также важны для определения количества вещества. В химических расчетах они позволяют определить количество вещества реагентов и продуктов, а также их массу и объем, учитывая закон сохранения массы и стехиометрические соотношения в реакции.
Использование коэффициентов в химии помогает ученым анализировать и предсказывать результаты химических реакций, разрабатывать новые вещества, оптимизировать процессы и улучшать понимание фундаментальных принципов химической науки.
Определение коэффициента в химии

Теперь давайте определим, что такое коэффициент в химии. Коэффициент в химии – это числовой множитель, который указывает на количество вещества, участвующего в химической реакции или реакционной формуле. Он обычно записывается перед формулой соединения или реагента и показывает, сколько молекул или атомов данного вещества участвует в реакции.
Коэффициент в химии помогает нам понять соотношение между различными веществами в реакции. Он также позволяет сбалансировать химическое уравнение, чтобы количество атомов каждого элемента на обоих сторонах реакции было одинаковым. Сбалансированное уравнение позволяет нам предсказывать результаты реакции и вычислять количество вещества, участвующего в процессе.
Например, в реакции горения метана (CH4) в атмосфере кислорода (O2), мы видим, что у метана коэффициент 1, а у кислорода – 2:
CH4 + 2O2 → CO2 + 2H2O
Здесь, коэффициент 2 перед O2 означает, что для полного сгорания одной молекулы метана нужно две молекулы кислорода.
Таким образом, коэффициенты играют важную роль в химических реакциях и формулах. Они помогают нам понять, как вещества соотносятся друг с другом и как они взаимодействуют. Поэтому, несмотря на то, что некоторые математические выражения могут пугать, коэффициенты дарят нам возможность исследовать и понимать химические процессы.
Применение коэффициента в химических реакциях
Одно из главных применений коэффициента в химических реакциях — это достижение баланса. Коэффициенты в уравнении реакции указывают, какие начальные вещества и какие конечные продукты участвуют в реакции. Они помогают соразмерить количество молекул каждого вещества, чтобы обеспечить сохранение массы и заряда в химической системе.
Применение коэффициента в химических реакциях также позволяет провести расчеты для определения массы вещества, который будет использоваться или получен в результате реакции. Зная коэффициенты в уравнении реакции и молярные массы веществ, можно определить массу каждого участвующего вещества и общую массу реакционной смеси.
Коэффициенты также используются для определения стехиометрических соотношений между веществами в реакции. Они позволяют вычислить количество реагента, необходимое для получения желаемого количества продукта. Такие расчеты имеют большое значение при проектировании и оптимизации химических процессов и производства.
Другое применение коэффициента в химических реакциях связано с прогнозированием и изучением химических свойств веществ. Зная коэффициенты реакции, можно предсказать, какие продукты будут образовываться и какие свойства они будут иметь. Это позволяет научным исследователям и инженерам разрабатывать новые материалы и улучшать существующие процессы.
Итак, применение коэффициента в химических реакциях является неотъемлемой частью изучения и понимания химии. Оно помогает балансировать уравнения реакций, проводить расчеты массы веществ и определять стехиометрические соотношения между ними. Благодаря коэффициенту мы можем понять и предсказать химические реакции и использовать эту информацию для создания новых материалов и процессов.
Значение коэффициента для балансировки химических уравнений
Вы когда-нибудь задумывались, как уравновесить химическое уравнение? Почему в уравнении нужно использовать коэффициенты? Давайте поговорим об этом и разберемся с этими вопросами!
Когда мы пытаемся балансировать химическое уравнение, мы стремимся установить соотношение между реагентами и продуктами реакции. Для достижения этой цели мы должны уравнять количество атомов каждого элемента с обеих сторон уравнения. И здесь на помощь приходят коэффициенты.
Коэффициенты в химии — это числа, записанные перед формулами веществ, указывающие, сколько молекул данного вещества участвуют в реакции. Они также определяют отношение между реагентами и продуктами и позволяют наладить баланс.
Теперь давайте взглянем на пример. Рассмотрим уравнение реакции горения метана:
CH4 + O2 → CO2 + H2O
Чтобы балансировать это уравнение, нам необходимо уравнять количество атомов каждого элемента с обеих сторон. Предположим, что мы хотим уравновесить количество атомов углерода. В левой стороне уравнения у нас есть один атом углерода в метане (CH4), а в правой стороне у нас есть один атом углерода в диоксиде углерода (CO2). Поэтому, чтобы согласовать количество атомов углерода, мы добавляем коэффициент 1 перед CO2 в правой стороне:
CH4 + O2 → 1CO2 + H2O
Теперь у нас один атом углерода с обеих сторон.
Мы продолжаем этот процесс, балансируя количество атомов других элементов, включая водород (H), кислород (O) и т.д., путем добавления соответствующих коэффициентов перед формулами веществ.
Таким образом, значение коэффициента для балансировки химических уравнений заключается в том, чтобы установить соответствие между количеством атомов каждого элемента на обеих сторонах уравнения. Это помогает нам верно представить реакцию и является одним из главных принципов химии.
Итак, теперь, когда вы знаете о значении коэффициента для балансировки химических уравнений, вы можете быть уверены, что справитесь с этой задачей! Удачи в ваших химических экспериментах!
Основные принципы коэффициента в химии
Важным принципом коэффициента в химии является его соотношение с массой вещества. Коэффициент может быть безразмерным, но может также выражаться в единицах измерения массы, молярной концентрации и других физических или химических величинах. Это зависит от конкретной химической реакции и ее условий.
Коэффициенты также отражают соотношение между различными реагентами и продуктами, которые участвуют в реакции. Они позволяют определить, какие вещества являются исходными веществами для реакции и какие вещества образуются в результате.
Они также помогают определить правильную последовательность химических реакций и учитывать закон сохранения массы и энергии. Коэффициенты позволяют балансировать химические уравнения, чтобы обеспечить равенство числа атомов каждого элемента на обеих сторонах уравнения. Это основная цель использования коэффициентов в реакциях.
Имея правильное соотношение коэффициентов, химики могут предсказывать характеристики реакции и ее результаты. Коэффициенты также позволяют определить только необходимое количество вещества для реакции, что помогает экономить ресурсы и эффективно использовать химические реакции в различных областях, таких как промышленность, медицина и наука.
Таким образом, основные принципы коэффициента в химии включают балансирование и соотношение веществ в реакциях, определение массы и количество вещества, сохранение массы и энергии, а также предсказание характеристик и результатов реакций.
Молекулярное соотношение и коэффициент
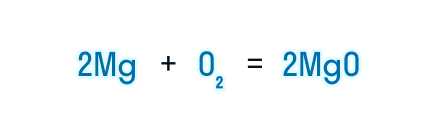
Когда мы изучаем химию, важно понимать, что молекулы разных веществ соединяются в определенных пропорциях. Эти пропорции описываются при помощи молекулярных соотношений и коэффициентов.
Молекулярное соотношение это просто отношение количества атомов разных элементов в молекуле. Важно помнить, что эти отношения всегда целочисленные, потому что атомы не могут быть разделены. Например, воду (H2O) можно рассматривать как молекулу, состоящую из двух атомов водорода (H) и одного атома кислорода (O). Это означает, что молекулярное соотношение воды составляет 2 к 1.
Коэффициенты используются для более точного описания реакций. Они показывают, сколько молекул каждого вещества участвует в реакции. Коэффициенты можно представить числами, которые записываются перед формулами веществ в химическом уравнении. Например, уравнение реакции сгорания метана (CH4) выглядит следующим образом: CH4 + 2O2 -> CO2 + 2H2O. В этом уравнении коэффициенты перед CH4, O2, CO2 и H2O определяют количество молекул каждого вещества, участвующего в реакции.
Зачем нам нужны молекулярные соотношения и коэффициенты? Они позволяют предсказывать и объяснять результаты химических реакций. Ведь если мы знаем, сколько молекул каждого вещества участвует в реакции, мы можем вычислить, сколько продуктов образуется. Уравнение реакции может служить своего рода «картой», которая показывает, какие вещества взаимодействуют и какие образуются.
Также важно понимать, что молекулярные соотношения и коэффициенты могут помочь нам использовать наши знания о химических реакциях на практике. Например, они позволяют определить, сколько вещества необходимо использовать, чтобы получить нужное количество продукта. Таким образом, знание молекулярных соотношений и коэффициентов может быть полезным в нашей повседневной жизни.
- Отношение количества атомов разных элементов в молекуле называется молекулярным соотношением.
- Коэффициенты в химических уравнениях показывают, сколько молекул каждого вещества участвует в реакции.
- Молекулярные соотношения и коэффициенты помогают нам предсказывать и объяснять результаты химических реакций.
- Знание молекулярных соотношений и коэффициентов может быть полезным в повседневной жизни.
Коэффициент в химии: определение и основные принципы
В химии коэффициентами называют числовые значения, указывающие на количество молекул или атомов вещества, участвующего в химической реакции или присутствующего в химическом соединении. Коэффициенты используются для записи химических уравнений и балансировки реакций.
Основные принципы использования коэффициентов в химии:
- Балансировка реакций: коэффициенты используются для объяснения, какие вещества участвуют в химической реакции и в каких пропорциях. Когда химическое уравнение несбалансировано, то есть количество атомов различных элементов на левой и правой сторонах уравнения не совпадает, коэффициенты могут быть использованы для балансировки уравнения.
- Определение степени реакции: коэффициенты могут указывать на количество молекул или атомов, которые участвуют в химической реакции. Они могут быть использованы для определения степени реакции, то есть насколько сильно реакция происходит.
- Расчеты количества вещества: коэффициенты могут быть использованы в различных химических расчетах, например, для определения количества продуктов реакции или расчета энергетических параметров.
Таким образом, коэффициенты являются важным инструментом в химии, который позволяет более точно описывать химические реакции и соединения.