Квантовые числа — это важное понятие в химии, которое помогает определить электронную структуру атомов и молекул. Они играют ключевую роль в объяснении и предсказании свойств вещества. Каждый электрон в атоме имеет уникальное набор квантовых чисел, которые описывают его энергию, орбитальный момент и магнитное поле.
Основные принципы квантовых чисел опираются на квантовую механику и принципы неопределенности. Они позволяют определить разрешенные значения энергии и орбитального момента электрона, а также его ориентацию в пространстве. Знание квантовых чисел позволяет углубиться в понимания химических связей, реакций и спектроскопических характеристик вещества.
Определение квантовых чисел в химии
Что такое квантовые числа в химии? Как они связаны с атомами и молекулами? Это интересная тема, и сегодня я хотел бы поделиться с вами некоторыми основными принципами и определением квантовых чисел.
Квантовые числа являются фундаментальными величинами, используемыми в квантовой механике для описания состояния электронов в атомах и молекулах. Они определяют возможные энергетические состояния электронов, их орбитали, форму и ориентацию.
Первое квантовое число, называемое главным квантовым числом (n), определяет энергию электрона и его основную орбиту вокруг ядра. Оно принимает целочисленные значения от 1 и выше. Чем больше значение n, тем выше энергия электрона и его орбита.
Второе квантовое число, называемое орбитальным квантовым числом (l), определяет форму орбитали электрона. Оно принимает значения от 0 до (n-1) и представляет собой номер подорбиты в рамках главной орбиты. Например, при n = 2 орбитальное квантовое число может быть равно 0 или 1, что соответствует s- и p-подорбитам соответственно.
Третье квантовое число, называемое магнитным квантовым числом (m), определяет ориентацию орбитали электрона относительно внешнего магнитного поля. Оно принимает значения от -l до +l, что позволяет определить различные магнитные подуровни в рамках каждой подорбиты.
Наконец, четвертое квантовое число, называемое спиновым квантовым числом (s), определяет направление вращения электрона вокруг своей оси. Оно может принимать значения +1/2 и -1/2, представляя два возможных ориентации спина.
Таким образом, квантовые числа в химии играют важную роль в определении электронной структуры атомов и молекул. Они помогают предсказать возможные химические связи и реактивность вещества. Понимание этих чисел помогает углубить наши знания о мире химии и рассказать о многообразии его явлений.
Основные принципы квантовых чисел
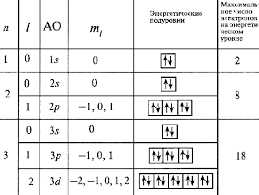
Первым из основных квантовых чисел является главное квантовое число (n). Оно определяет энергию электрона и его удаленность от ядра атома. Главное квантовое число может принимать только положительные целочисленные значения, например, 1, 2, 3 и т.д.
Вторым основным квантовым числом является орбитальное квантовое число (l). Оно определяет форму орбитали электрона и его ориентацию в пространстве относительно ядра атома. Орбитальное квантовое число может принимать значения от 0 до (n-1), где n — главное квантовое число.
Третьим основным квантовым числом является магнитное квантовое число (m). Оно определяет ориентацию орбитали электрона в пространстве относительно заданной оси. Магнитное квантовое число может принимать значения от -l до +l.
Наконец, четвертым основным квантовым числом является спиновое квантовое число (s). Оно определяет вращение электрона вокруг своей оси и его магнитный момент. Спиновое квантовое число может принимать значения +1/2 или -1/2.
Эти основные принципы квантовых чисел помогают определить распределение электронов в электронных облаках и объяснить химические свойства атомов и молекул. Они позволяют нам понять, почему атомы образуют химические связи и как происходят химические реакции.
Итак, основные принципы квантовых чисел — это набор чисел, которые определяют электронную структуру атомов и молекул. Они позволяют нам лучше понять мир химии и взаимодействие веществ, а также открыть новые возможности в различных областях науки и технологии.
Квантовое число главного квантового числа (n)
Итак, давайте зададимся вопросом: что же означает главное квантовое число (n)? В краткой форме, n указывает на размер и энергию электронной оболочки. Но давайте понимать это более глубоко.
Главное квантовое число может принимать целочисленные значения, начиная с единицы (n = 1), и это число соответствует энергетическому уровню атома. Чем больше значение главного квантового числа, тем дальше электронная оболочка от ядра атома и тем выше энергия данного электрона.
Размеры электронной оболочки также связаны с главным квантовым числом. По мере увеличения n, электронная оболочка становится более размытой и занимает больше пространства вокруг ядра атома. В зависимости от значения главного квантового числа, мы можем сказать, на каком «уровне» атома находится данный электрон. Но помните, что на самом деле электрон находится в вероятностной области, называемой электронной областью или «облаком» электрона.
Таким образом, главное квантовое число (n) играет важную роль в химии, позволяя нам определить характеристики атомов и их электронных оболочек. Оно помогает нам понять распределение электронов и их энергетические уровни, что имеет важное значение при изучении связей между атомами и молекулами.
Квантовое число орбитальной формы (l)
Квантовое число орбитальной формы может принимать значения от 0 до n-1, где n — главное квантовое число (определяет энергию и размер электронной оболочки). Каждое значение l соответствует определенной форме орбитали.
| Значение l | Форма орбитали |
|---|---|
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
Орбитали s имеют сферическую форму и ближе всего расположены к ядру атома. Орбитали p вытянуты и удлинены по осям координат x, y и z. Орбитали d имеют более сложную форму и включают дополнительные области с высокой электронной плотностью. Орбитали f имеют еще более сложную форму и также содержат дополнительные области с высокой электронной плотностью.
Квантовое число орбитальной формы важно для понимания электронной структуры атома и свойств химических элементов. Оно помогает определить, как электроны распределяются вокруг ядра атома и взаимодействуют с другими элементами.
Надеюсь, теперь ты лучше понимаешь, что такое квантовое число орбитальной формы и как оно связано с электронной структурой атомов. Если у тебя еще возникли вопросы, не стесняйся задавать их!
Квантовое число орбитального момента (m)
Как мы всё знаем, атом состоит из ядра и электронной оболочки. Электронная оболочка состоит из электронных орбиталей, которые представляют собой трехмерные области пространства, где вероятность нахождения электрона наибольшая. Чтобы описать эти орбитали, мы используем четыре квантовых числа: главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s).
Квантовое число орбитального момента (m) имеет значение от -l до +l. Оно определяет ориентацию орбитали в пространстве в отношении заданной оси. Например, если значение квантового числа орбитального момента равно 0, это означает, что орбиталь ориентирована по направлению этой оси, исходя из которой обозначено значение оси орбитали. Если значение m положительное, то орбиталь ориентирована в одном направлении, а если значение m отрицательное, то орбиталь ориентирована в противоположном направлении.
Квантовое число орбитального момента (m) связано с орбитальным квантовым числом (l) следующим образом: m принимает значения от -l до +l включительно. Например, если орбитальное квантовое число (l) равно 2, то значения квантового числа орбитального момента (m) могут быть -2, -1, 0, 1 или 2.
Знание квантовых чисел позволяет нам понять энергетические уровни электронов в атоме и их распределение по орбиталям. Квантовые числа также являются основой для построения электронных конфигураций атомов и химических связей.
Квантовое число спина (s)
Когда мы говорим о квантовых числах, помимо чисел самого спина (s), также важно упомянуть, что каждая частица могут быть описаны еще тремя квантовыми числами: главным (n), орбитальным (l) и магнитным (ml). Главное квантовое число определяет энергию электрона, орбитальное квантовое число определяет форму орбитали, а магнитное квантовое число определяет ориентацию орбитали в пространстве.
Спин является важным параметром, который влияет на свойства и поведение частицы, таких как магнитное поле, спектры и т.д. Квантовое число спина также используется для определения определенных правил и закономерностей, связанных с заполнением электронных оболочек атомов и молекул.
Интересно, что спин является уникальным феноменом квантовой физики. Он не имеет аналога в классической механике, и можно лишь сказать, что это свойство является внутренним моментом частицы.
Таким образом, квантовое число спина (s) играет решающую роль в химии и физике, позволяя нам понять и описывать строение и свойства атомов и молекул. Оно помогает нам лучше понять мир вокруг нас и открывает новые возможности в области научных исследований и разработок.
Основные квантовые числа:
1. Главное квантовое число (n) — определяет основной энергетический уровень электрона. Оно может принимать целые значения от 1 и выше. Чем больше значение главного квантового числа, тем выше энергия электрона и дальше располагается орбиталь.
2. Орбитальное или азимутальное квантовое число (l) — определяет форму орбитали и значения момента импульса электрона вокруг ядра атома. Оно может принимать значения от 0 до (n-1). Например, если главное квантовое число равно 2, то орбитальное квантовое число может быть 0 или 1.
3. Магнитное квантовое число (ml) — определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l включительно. Например, если орбитальное квантовое число равно 1, то магнитное квантовое число может быть -1, 0 или 1.
4. Спиновое квантовое число (ms) — определяет направление спина электрона. Оно может принимать значения +1/2 или -1/2.
Квантовые числа позволяют строить электронную конфигурацию атомов и молекул, а также описывать их химические свойства и взаимодействия.