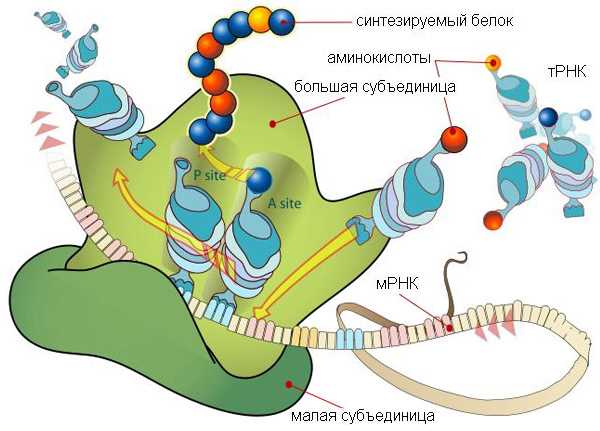
Когда мы говорим о биологии, мы часто сталкиваемся с таким понятием, как аминокислоты. Это органические молекулы, являющиеся основой для синтеза белков. Аминокислоты могут быть поларными или неполярными в зависимости от своей химической структуры.
Неполярные аминокислоты имеют гидрофобные свойства, то есть не растворяются в воде. Они играют важную роль в множестве биологических процессов, таких как сворачивание белков, формирование мембран и химические реакции в клетках.
Понимание роли неполярных аминокислот в биологии позволяет нам лучше понимать сложные механизмы жизни и развития организмов на молекулярном уровне.
Неполярные аминокислоты
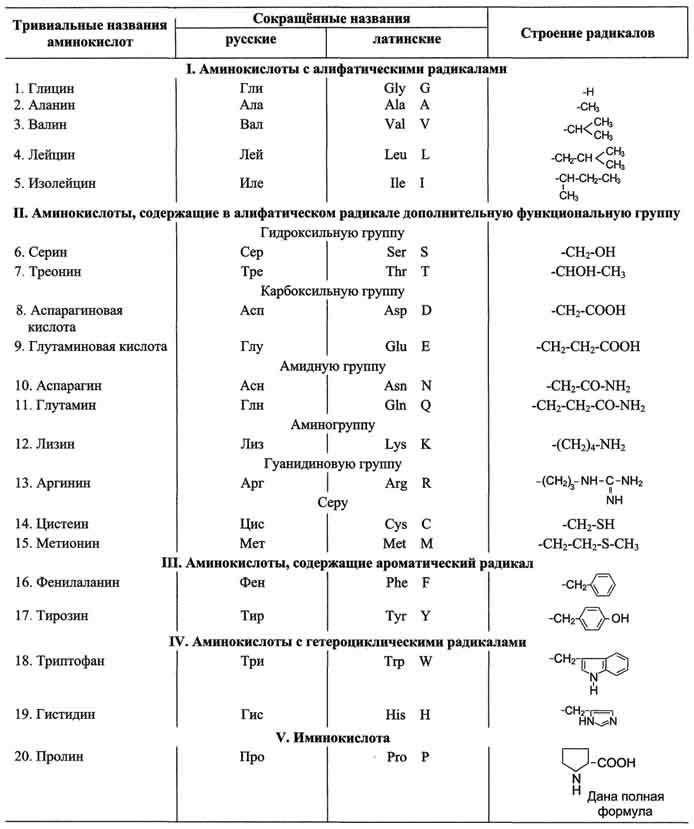
Одним из классов аминокислот являются неполярные аминокислоты. Как неполярные соединения, они обладают гидрофобными свойствами, что означает, что они не растворяются в воде. Вместо этого, они хорошо растворяются в неполярных растворителях, таких как жиры и масла.
Неполярные аминокислоты включают глицин, пролин, валин, лейцин, изолейцин, метионин, фенилаланин и триптофан. Их структура характеризуется преимущественно атомами углерода и водорода, с небольшими числом функциональных групп.
Играя важную роль в биологии, неполярные аминокислоты выполняют несколько функций. С одной стороны, они служат строительными блоками для синтеза белков, которые, в свою очередь, являются основными молекулами, выполняющими широкий спектр функций в организме. Белки необходимы для роста, развития и восстановления клеток, а также являются ключевыми ферментами, участвующими в реакциях обмена веществ.
Неполярные аминокислоты также могут использоваться организмом в качестве источников энергии. Когда организм нуждается в дополнительной энергии, он может разбирать белки и использовать их аминокислоты для синтеза ATP — основной формы энергии в клетках.
Поэтому, хотя неполярные аминокислоты могут показаться невзрачными или менее значимыми по сравнению с другими классами аминокислот, они на самом деле играют важную роль в жизнедеятельности организмов. Они поддерживают не только структурные, но и функциональные аспекты, обеспечивая нормальное функционирование клеток и биологических систем в целом.
Так что, неполярные аминокислоты — это нечто более, чем просто малозначительные элементы в составе биологических систем. Они являются ключевыми игроками в сложной симфонии жизни, которая происходит в нашем организме. Без них, наш организм не мог бы эффективно функционировать, и эта удивительная способность к жизни, которую мы ценим, не была бы возможной.
Определение и классификация неполярных аминокислот
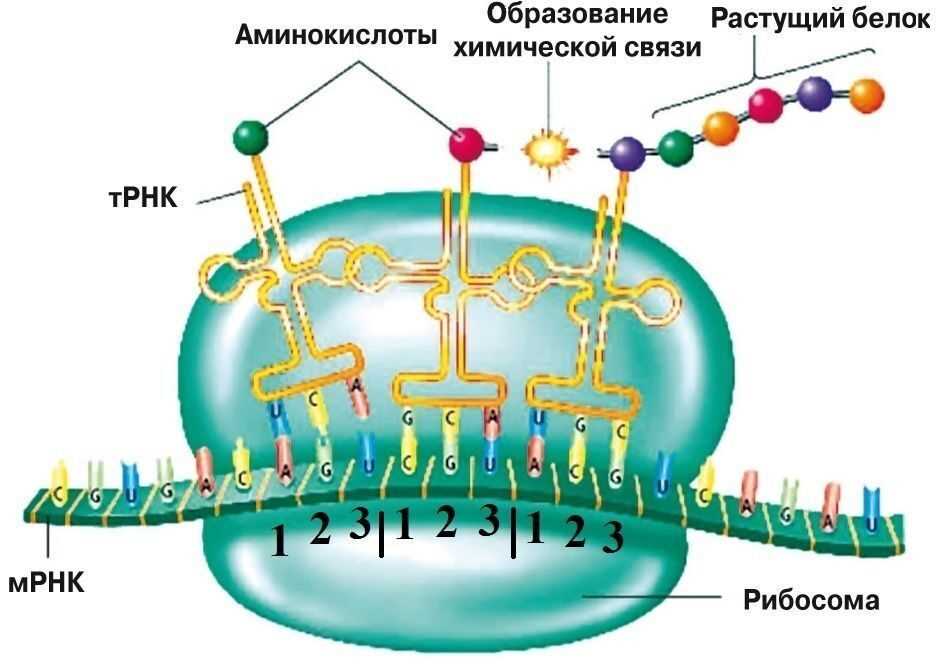
Неполярные аминокислоты — это те, которые не содержат заряда и не способны образовывать водородные связи с водой. Они характеризуются гидрофобностью, что означает, что они имеют большую аффинность к гидрофобным средам, таким как мембраны клеток или внутреннее пространство белков.
Неполярные аминокислоты можно классифицировать на основе различных свойств, таких как размер, форма и химический состав. Однако основная классификация основана на их химической структуре и свойствах боковой цепи.
- Алифатические неполярные аминокислоты: это аминокислоты с простой алифатической боковой цепью, которая состоит из углеродных и водородных атомов. Примерами таких аминокислот являются глицин, аланин, валин, лейцин и изолейцин.
- Ароматические неполярные аминокислоты: это аминокислоты, в которых боковая цепь содержит ароматические кольца. Тирозин, фенилаланин и трптофан являются примерами ароматических неполярных аминокислот.
- Гидрокарбоновые неполярные аминокислоты: это аминокислоты, содержащие боковую цепь, состоящую из углеродных атомов и водородных атомов, но без ароматических кольцевых структур. Метионин и цистеин являются гидрокарбоновыми неполярными аминокислотами.
Все неполярные аминокислоты обладают общим свойством — отсутствие заряда, можно сравнить их с нейтральными частицами. Это делает их гидрофобными и способными образовывать гидрофобные взаимодействия с другими неполярными аминокислотами или гидрофобными областями белков. Такая специфическая классификация неполярных аминокислот дает возможность понять их роль в различных биологических процессах.
Химические свойства
Слабое взаимодействие с водой связано с тем, что неполярные аминокислоты имеют гидрофобные боковые цепи, состоящие в основном из углеродных и водородных атомов. Эти боковые цепи притягиваются друг к другу гидрофобным взаимодействием, формируя неидеальную конфигурацию белка в водной среде.
Эта гидрофобная природа неполярных аминокислот играет важную роль в структурной организации белков. Они обычно находятся внутри белка, формируя гидрофобные ядра, которые способствуют его стабильности и складыванию. Это особенно важно для белков, которые существуют в гидрофобной среде, такой как мембраны клеток или гидрофобные промежутки в белковых каналах.
Еще одним интересным химическим свойством неполярных аминокислот является их способность образовывать взаимодействия с другими неполярными аминокислотами. Эти взаимодействия могут быть формой водородных связей или гидрофобных взаимодействий, которые способствуют формированию структурных элементов белка, таких как а-спирали и спиральные обратные петли.
Однако, несмотря на свою гидрофобность, неполярные аминокислоты также могут играть роль во многих других процессах, таких как катализ реакции, участие в связывании молекул и транспорте веществ. Их разнообразные свойства и способность взаимодействовать с другими аминокислотами делают их важным элементом в биологических системах.
Роль в структуре белка
Неполярные аминокислоты также играют важную роль в структуре белка. Они обладают гидрофобными свойствами, а значит не образуют водородных связей с водой и предпочитают взаимодействовать друг с другом. Это способствует формированию гидрофобного ядра внутри белка, что является ключевым компонентом его стабильности и свертывания.
Гидрофобные аминокислоты, такие как лейцин, изолейцин и валин, обычно сосредоточены в гидрофобном ядре белка. Они создают гидрофобные области в структуре белка, которые отталкивают воду и позволяют белку сохранять свою форму в водной среде клетки.
Кроме того, неполярные аминокислоты могут быть также важными для связывания других молекул внутри белка. Некоторые из них обладают свойствами, позволяющими им вступать в гидрофобные взаимодействия с другими аминокислотами или молекулами. Это способствует созданию устойчивых белковых структур и обеспечивает активность белка внутри клетки.
В целом, неполярные аминокислоты играют критическую роль в структуре белка, определяя его стабильность, свертываемость и функциональность. Они вносят важный вклад в создание трехмерной формы белка, которая является основой для его функции в клетке. Понимание роли неполярных аминокислот в структуре белка позволяет нам лучше понять механизмы биологических процессов и разработать новые методы лечения и терапии различных заболеваний.
Взаимодействие неполярных аминокислот с другими молекулами
Неполярные аминокислоты играют важную роль в биологических системах и взаимодействуют с другими молекулами, способствуя функционированию организма. Эти аминокислоты, такие как глицин, лейцин, изолейцин и валин, отличаются от полярных аминокислот тем, что они не содержат функциональных групп, способных образовывать водородные связи.
Неполярные аминокислоты обладают гидрофобными свойствами, что делает их нерастворимыми в воде. Однако, они могут взаимодействовать с другими неполярными молекулами, такими как липиды, которые образуют основную составляющую клеточной мембраны. Гидрофобные свойства неполярных аминокислот позволяют им встраиваться в липидный двойной слой мембраны, обеспечивая ее устойчивость и функциональность.
Другой важный аспект взаимодействия неполярных аминокислот — это их роль в формировании гидрофобных областей внутри белковой структуры. Белки, состоящие из цепочек аминокислот, имеют различную структуру и форму, и неполярные аминокислоты могут заполнить внутренние гидрофобные полости, что способствует их стабильности и функциональности.
Кроме того, неполярные аминокислоты могут взаимодействовать с гидрофобными лигандами, такими как липиды и гормоны, истикивая их и обеспечивая их транспорт по организму. Например, лейцин и изолейцин играют важную роль в транспорте и метаболизме жирных кислот.
Таким образом, неполярные аминокислоты выполняют ряд важных функций взаимодействуя с другими молекулами, обеспечивая устойчивость и функциональность белков, участвуют в транспорте и метаболизме различных веществ, а также играют ключевую роль в формировании мембран и их функционировании.
Неполярные аминокислоты: понятие и роль в биологии
Неполярные аминокислоты, также известные как гидрофобные аминокислоты, имеют гидрофобное химическое свойство. Это означает, что они не растворяются в воде, а предпочитают сосуществовать с другими неполярными аминокислотами в гидрофобных областях белка.
Неполярные аминокислоты имеют важную роль в биологии. Во-первых, они способствуют формированию структуры белков, обеспечивая гидрофобные области, которые играют ключевую роль в их функционировании. Неполярные аминокислоты также могут образовывать гидрофобные кластеры внутри белка, что помогает сохранять его стабильность и защищает от воздействия внешних факторов.
Кроме того, неполярные аминокислоты играют важную роль в выделении мембраны клетки. Они образуют гидрофобный ядро мембранного слоя, которое предотвращает проникновение воды и поларных молекул. Это особенно важно для мембран клеточных органелл, таких как митохондрии и эндоплазматическая сеть, где обеспечивается передача сигналов и транспорт веществ.
Примеры неполярных аминокислот:
- Глицин (Gly)
- Аланин (Ala)
- Валин (Val)
- Лейцин (Leu)
- Изолейцин (Ile)
- Пролин (Pro)
- Метионин (Met)
- Фенилаланин (Phe)
- Триптофан (Trp)