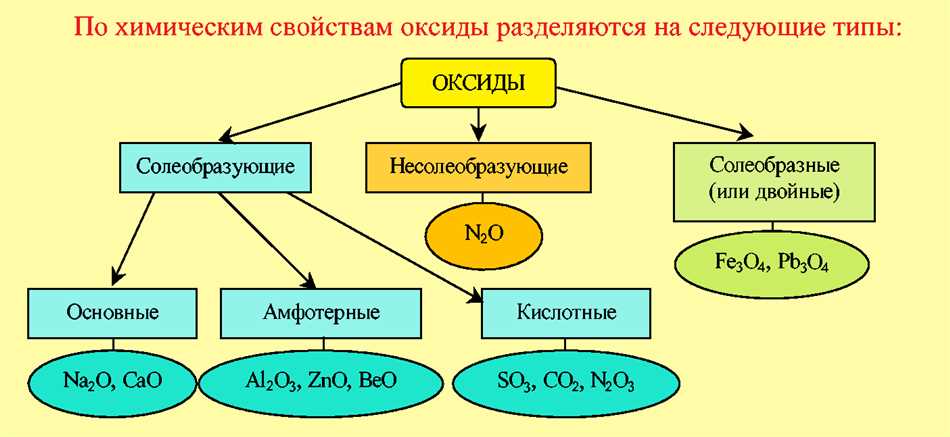
Когда мы услышиваем слово «оксид», мы обычно ассоциируем его с солеобразующими свойствами. Однако, существуют и так называемые несолеобразующие оксиды – это оксиды, которые не реагируют с кислотами и не образуют соли.
Несолеобразующие оксиды обладают рядом интересных свойств, которые делают их полезными в различных областях. Они могут использоваться в качестве катализаторов, для синтеза органических соединений, а также в производстве электроники и керамики.
Давайте погрузимся в мир несолеобразующих оксидов и узнаем больше об их определении и свойствах.
- Определение:
- Что такое несолеобразующий оксид?
- Свойства несолеобразующих оксидов
- Примеры несолеобразующих оксидов
- Свойства несолеобразующих оксидов:
- 1. Физические свойства:
- 2. Химические свойства:
- 3. Примеры несолеобразующих оксидов:
- Физические свойства несолеобразующих оксидов
- Химические свойства несолеобразующих оксидов
- Применение несолеобразующих оксидов
- Использование несолеобразующих оксидов в промышленности
- Несолеобразующие оксиды: определение и свойства
- Свойства несолеобразующих оксидов:
Определение:
Давайте представим себе гостеприимный химический мир, где каждое вещество имеет свой собственный характер. Одинокая молекула оксида, плавающая в этом мире, мечтает об образовании крепкой связи с другими молекулами. Но у нее нет силы, чтобы стать солью. Она ищет свою родственную душу, но не может найти никого, к кому присоединиться. Такая молекула — это несолеобразующий оксид.
Итак, несолеобразующие оксиды не могут образовывать соли. Они имеют специфические свойства и могут использоваться в различных целях. Некоторые из них имеют промышленное применение, а другие используются в лаборатории для проведения химических экспериментов. Они имеют разнообразные свойства, что делает их интересными и полезными для научных исследований.
Таким образом, несолеобразующие оксиды — это группа веществ, которые имеют свои особенности и играют важную роль в мире химии. Они могут быть как полезными, так и опасными, но в конечном счете они помогают нам лучше понять химические процессы и применять их в нашей жизни.
Что такое несолеобразующий оксид?
Свойства несолеобразующих оксидов
Несолеобразующие оксиды проявляют ряд уникальных свойств, которые отличают их от других оксидов. Одно из основных свойств несолеобразующих оксидов — это их нейтральное или слабощелочное действие в растворе.
В отличие от кислот, несолеобразующие оксиды не образуют ионов водорода (H+) в водном растворе. Вместо этого они могут взаимодействовать с молекулами воды, образуя гидроксиды. Например, оксид натрия (Na2O) взаимодействует с водой, образуя натриевый гидроксид (NaOH).
- Несолеобразующие оксиды часто обладают щелочными свойствами и могут использоваться в процессе нейтрализации кислот. Это значит, что они могут помочь уравновесить pH раствора и снизить его кислотность. Например, оксид кальция (CaO) может использоваться для нейтрализации сильных кислот.
- Несолеобразующие оксиды также могут выступать в качестве дезоксидантов, то есть они способны отнимать кислород от других веществ. Это свойство может быть полезно в различных процессах, например, при очистке металлов от примесей.
- Несолеобразующие оксиды также обладают высокой устойчивостью и могут быть использованы в различных промышленных процессах, включая производство стекла, керамики и других материалов.
Теперь вы, наверняка, задаете себе вопрос: «Как и когда я могу столкнуться с несолеобразующим оксидом в повседневной жизни?» Ну, вот несколько примеров:
- Ваша зубная паста может содержать несолеобразующий оксид, такой как оксид кремния (SiO2), который помогает очищать и полировать зубы. Вы уже имели дело с несолеобразующим оксидом и не знали об этом!
- Оксид алюминия (Al2O3) — это несолеобразующий оксид, который используется в производстве керамики и посуды.
- И наконец, оксид железа (Fe2O3), или ржавчина, является примером несолеобразующего оксида. Вы, вероятно, видели его на металлических предметах, которые вышли из строя из-за окисления.
Теперь, когда вы знаете, что такое несолеобразующий оксид, вы можете применить эту информацию в своей повседневной жизни и быть в курсе того, какие вещества и какие свойства у них есть.
Вопрос к вам: какие другие примеры несолеобразующих оксидов вы можете назвать или вспомнить?
Примеры несолеобразующих оксидов
Несолеобразующие оксиды представляют собой химические соединения, которые не образуют соли при взаимодействии с кислотами. Они обладают определенными характеристиками, которые делают их незаменимыми в различных отраслях промышленности и науки.
Вот несколько примеров несолеобразующих оксидов:
- Диоксид углерода (CO2) — один из наиболее известных несолеобразующих оксидов. Он является продуктом сгорания углеводородов и находится в составе воздуха. Диоксид углерода используется в производстве газированных напитков, приготовлении сухого льда и в других отраслях промышленности.
- Азота оксид (NO) — это газообразное вещество, которое образуется в результате сгорания или окисления азота. Он важен для поддержания биологического баланса в атмосфере и является одним из компонентов загрязнения воздуха.
- Азот триоксид (NO3) — это ядовитое и коррозионное вещество, которое образуется при взаимодействии азота с кислородом. Он используется в производстве различных химических соединений и удобрений, но требует осторожного обращения из-за своей высокой токсичности.
Это лишь несколько примеров несолеобразующих оксидов, которые широко используются в различных отраслях исследований и производства. Они демонстрируют важность этих соединений и их роль в нашей повседневной жизни. Интересно, знаете ли вы другие примеры несолеобразующих оксидов?
Свойства несолеобразующих оксидов:

1. Физические свойства:
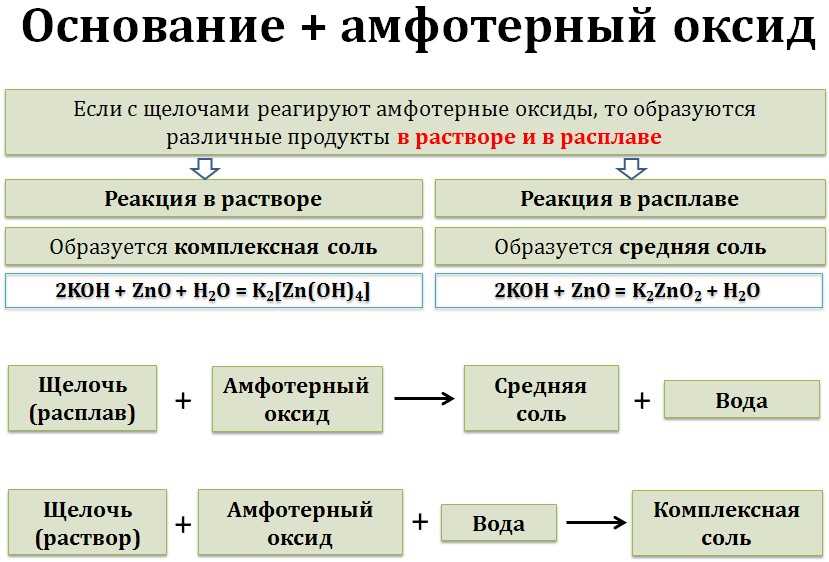
- Несолеобразующие оксиды обычно имеют высокую температуру плавления и кипения.
- Они могут быть газообразными, жидкими или твердыми веществами.
- Некоторые из них обладают металлическим блеском и хорошей теплопроводностью.
2. Химические свойства:
- Несолеобразующие оксиды не реагируют с водой и не образуют кислоты или основания.
- Они не растворяются в воде и не проявляют кислотные или щелочные свойства.
- Однако они могут реагировать с кислородом или другими химическими элементами, образуя соединения.
3. Примеры несолеобразующих оксидов:
- Оксид углерода (CO)
- Оксид азота (NO)
- Оксид серы (SO2)
- Оксид фосфора (P2O5)
- Оксид азота II (NO2)
Таким образом, несолеобразующие оксиды имеют свои уникальные свойства, которые определяют их нежелание образовывать кислоты или основания при взаимодействии с водой. Эти свойства делают их важными в различных областях науки и технологий, таких как химическая промышленность, металлургия и электроника.
Физические свойства несолеобразующих оксидов
- Твердотельность: Несолеобразующие оксиды чаще всего встречаются в виде твердых веществ. Это означает, что они обладают определенной структурой и могут быть использованы для создания различных материалов и конструкций.
- Высокая температура плавления: Многие несолеобразующие оксиды имеют очень высокую температуру плавления, что делает их полезными в качестве огнестойких материалов. Они способны выдерживать крайне высокие температуры без изменения своей структуры или свойств.
- Электропроводность: Некоторые несолеобразующие оксиды обладают электропроводящими свойствами. Это делает их важными в различных электронных устройствах, таких как датчики, сенсоры и транзисторы. Благодаря электропроводности, эти оксиды могут быть использованы в проводящих пленках и электроде материалах.
- Магнитные свойства: Некоторые несолеобразующие оксиды могут обладать магнитными свойствами. Это делает их полезными в области магнитных материалов и устройств.
- Прозрачность: Некоторые несолеобразующие оксиды могут быть прозрачными для видимого света. Это делает их полезными в различных оптических устройствах, таких как линзы, окна и оптические светофильтры.
В целом, несмотря на свою разнообразность, несолеобразующие оксиды обладают уникальными физическими свойствами, которые делают их полезными в широком спектре применений. Они являются важными строительными блоками для различных материалов и устройств, а также помогают нам лучше понять и использовать мир вокруг нас.
Химические свойства несолеобразующих оксидов
Одно из основных химических свойств несолеобразующих оксидов — их способность взаимодействовать с водой. Некоторые несолеобразующие оксиды образуют сильные кислоты при реакции с водой, такие как диоксид серы (SO2) или диоксид азота (NO2). Эти кислоты могут быть ядовитыми и вызывать раздражение глаз и дыхательных путей.
Другие несолеобразующие оксиды, такие как оксид азота (NO) и оксид углерода (CO), являются газами и обладают определенными свойствами, которые важны для понимания их роли в атмосфере. Например, оксид азота является ключевым фактором в формировании смога и кислотных дождей.
Особое внимание в химии уделяется свойствам оксидов переходных металлов. Эти оксиды обладают сложными свойствами, включая способность каталитического действия, а также возможность изменять свою степень окисления.
Несолеобразующие оксиды также могут взаимодействовать с другими химическими соединениями, такими как органические вещества или другие неоксидные соединения, и образовывать новые соединения. Например, оксид азота может реагировать с органическими веществами в атмосфере и образовывать озон, который в свою очередь является главным компонентом тропосферного озона.
Химические свойства несолеобразующих оксидов широко изучены и позволяют нам лучше понять их роль в природе и применение в различных отраслях, таких как промышленность, медицина и охрана окружающей среды.
Применение несолеобразующих оксидов
Одним из наиболее распространенных применений несолеобразующих оксидов является использование их в качестве катализаторов в химических реакциях. Например, оксиды металлов, такие как оксид железа и оксид цинка, широко используются в катализе различных процессов. Эти оксиды обладают способностью ускорять химические реакции, не участвуя в них непосредственно.
Еще одним важным применением несолеобразующих оксидов является их использование в производстве керамики и стекла. Например, оксид кремния используется для придания прочности и устойчивости керамическим и стеклянным изделиям. Оксиды других металлов, такие как оксид алюминия и оксид титана, также используются в производстве керамических материалов.
Несолеобразующие оксиды также находят применение в электронике и солнечных батареях. Оксиды металлов, такие как оксид кадмия и оксид цинка, используются в полупроводниковой электронике для создания транзисторов и диодов. Эти оксиды обладают полупроводниковыми свойствами и позволяют эффективно управлять потоком электричества.
Кроме того, несолеобразующие оксиды имеют применение в косметической и фармацевтической промышленности. Некоторые оксиды, например оксид железа, используются в качестве пигментов для косметических продуктов, таких как помады и тени для век. Они придают продуктам желаемый цвет и текстуру.
Использование несолеобразующих оксидов в промышленности
Несолеобразующие оксиды, такие как оксиды углерода, азота, серы и многие другие, играют важную роль в промышленности. Они используются в различных отраслях для производства разнообразных продуктов и процессов.
Оксиды углерода — это одни из самых распространенных несолеобразующих оксидов, которые находят применение в промышленности. Оксид углерода II (CO) широко используется в процессе получения железа из руды. Важно отметить, что оксид углерода II является ядовитым газом, и его использование требует соблюдения специальных мер предосторожности.
Оксиды азота получают путем сжигания топочных газов, при котором в окружающую среду попадают оксиды азота II (NO) и азота IV (NO2). Они используются в промышленности для производства различных химических веществ, в том числе кислот и удобрений. Кроме того, оксиды азота играют важную роль в процессе очистки отработанных газов в специальных очистных установках.
Оксид серы (SO2) — важный несолеобразующий оксид, используемый в производстве серной кислоты и сульфата алюминия. Также он применяется в процессе получения бумаги и текстиля. Серный оксид является токсичным веществом и его использование требует использования средств защиты.
Na конечно важно учесть, что эти оксиды считаются вредными для окружающей среды и здоровья людей, поэтому их использование должно осуществляться с соблюдением всех необходимых мер предосторожности и контроля выбросов.
Однако помимо своих вредных свойств, несолеобразующие оксиды также имеют полезные свойства, и их использование в промышленности помогает производить широкий спектр продукции и обеспечивать надежность и эффективность различных производственных процессов. Эти оксиды продолжают играть важную роль в развитии и совершенствовании промышленности, и важно развивать новые технологии для минимизации их вредного воздействия на окружающую среду.
Несолеобразующие оксиды: определение и свойства
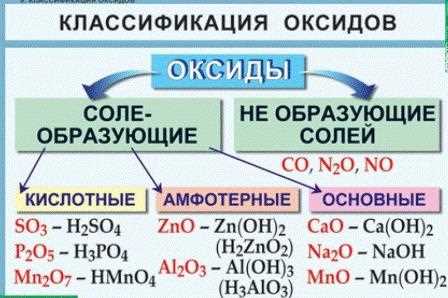
Несолеобразующие оксиды встречаются в природе и используются в различных отраслях промышленности. Они обладают определенными свойствами, которые делают их полезными в различных процессах.
Свойства несолеобразующих оксидов:
- Не растворимость в воде: Несолеобразующие оксиды не растворяются в воде и не образуют кислотные или щелочные растворы.
- Кислотность: Несолеобразующие оксиды могут выступать в качестве кислотных оксидов при взаимодействии с водой или основаниями.
- Физические свойства: Несолеобразующие оксиды могут быть твердыми (например, оксид кремния) или газообразными (например, оксид азота).
- Применение: Несолеобразующие оксиды используются в различных отраслях промышленности, например, оксид алюминия применяется в производстве керамики и стекла.
Несолеобразующие оксиды являются важной группой соединений, которые имеют свои специфические свойства и применения. Изучение этих соединений позволяет понять основные принципы химических реакций и использовать их в технологических процессах.