Когда мы слышим слово «основание», мы можем вспомнить множество различных вещей — фундамент здания, базу для развития и т.д. Но также существуют основания в химии, которые играют важную роль во многих процессах.
Основания в химии — это вещества, которые могут принимать или отдавать электроны, образуя ионы. Они обладают способностью отрицательно заряжать другие вещества и могут реагировать с кислотами.
Основания классифицируются на разные типы в зависимости от своей реактивности и свойств. Некоторые из основных классификаций включают сильные основания, слабые основания, ионные основания и неметаллические основания.
Давайте ближе рассмотрим каждый из этих типов оснований и разберем их свойства и применение в химических реакциях.
- Основания: определение и функции
- Классификация оснований по химическому составу
- Однобазные основания
- Двухбазные основания
- Амфотерные основания
- Сложные основания
- Примеры оснований
- Классификация оснований по свойствам
- Реакция с водой
- Содержание ионов гидроксида
- Восстановительная способность
- Реакции оснований
- Основания в химии и их классификация
Основания: определение и функции
Основания — это химические соединения, которые обладают способностью принимать протоны от кислоты, образуя водородные ионы. На самом деле, можно сказать, что основания «нейтрализуют» кислоты. Они имеют щелочные свойства и обычно образуют щелочные растворы в воде.
Основания классифицируются по различным критериям, включая их силу и реакционную способность. Можно говорить о сильных и слабых основаниях. Сильные основания, такие как гидроксид натрия или гидроксид калия, имеют высокую реакционную способность и полностью диссоциируют в растворе. Слабые основания, например, гидроксид аммония, имеют низкую реакционную способность и частично диссоциируют.
Теперь давайте поговорим о функциях оснований. Они имеют широкое применение в различных сферах нашей жизни.
1. Нейтрализация кислот: Основания играют важную роль в процессе нейтрализации, когда они реагируют с кислотами для образования солей и воды. Этот процесс является основой многих химических реакций.
2. Различные применения: Основания широко используются в различных областях, включая промышленность, медицину, косметику и бытовую химию. Например, гидроксид натрия используется в мыловарении и производстве стекла, а аммиак широко применяется в качестве удобрения в сельском хозяйстве.
3. Регулирование pH: Основания используются для регулирования уровня pH в различных системах. Например, гидроксид калия может использоваться в аккумуляторах для регулирования ионной концентрации.
4. Лекарственные препараты: Некоторые основания имеют медицинское значение и используются в качестве активных компонентов лекарственных препаратов. Например, щелочные антациды, такие как гидроксид магния, используются для снижения уровня кислоты в желудке и облегчения симптомов изжоги.
Вот несколько функций оснований. Вы видите, что они играют важную роль в нашей жизни и имеют множество применений. Хорошо ли вы поняли основы оснований? Если у вас есть вопросы, не стесняйтесь задавать их!
Классификация оснований по химическому составу
Однобазные основания
Однобазные основания состоят только из одного иона гидроксида (OH-). Примерами однобазных оснований являются гидроксиды натрия (NaOH), калия (KOH) и бария (Ba(OH)2).
Двухбазные основания
Двухбазные основания состоят из двух ионов гидроксида (OH-) и одного другого иона. Примером двухбазного основания является гидроксид аммония (NH4OH), который содержит два иона гидроксида и один ион аммония (NH4+).
Амфотерные основания
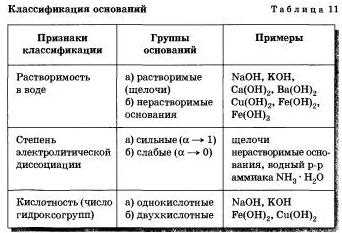
Амфотерные основания обладают свойствами и оснований, и кислот. Они могут реагировать как с кислотами, так и с основаниями, в зависимости от условий реакции. Примером амфотерного основания является гидроксид алюминия (Al(OH)3).
Сложные основания
Сложные основания состоят из нескольких ионов гидроксида и других ионов. Примерами сложных оснований являются гидроксид железа (II) (Fe(OH)2) и гидроксид железа (III) (Fe(OH)3).
Классификация оснований по химическому составу позволяет упорядочить и систематизировать их и помогает химикам более точно изучать их свойства и реакции. Это важно для разработки новых материалов и медикаментов на основе оснований.
Примеры оснований
Один из наиболее известных и широко используемых примеров оснований — это гидроксид натрия (NaOH), также известный как едкий натр. Он является одним из наиболее распространенных оснований и используется во многих отраслях промышленности, включая производство мыла, стекла и очистку воды.
Еще одним примером основания является гидроксид калия (KOH), он имеет широкий спектр применения, включая использование в химическом производстве, производстве удобрений и в медицине.
Кальциевый гидроксид (Ca(OH)2), или известь, является еще одним примером основания. Оно используется в строительной отрасли, а также в производстве цемента и многочисленных химических реакциях.
Аммиак (NH3) также считается основанием. Он широко используется в производстве удобрений, а также в холодильной промышленности и в качестве очистителя в бытовых условиях.
Пропиламина (C3H9N) — это еще один пример основания, который часто используется в производстве пластиков и резиновых изделий.
- Гидроксид натрия (NaOH)
- Гидроксид калия (KOH)
- Кальциевый гидроксид (Ca(OH)2)
- Аммиак (NH3)
- Пропиламина (C3H9N)
Это только несколько примеров из множества оснований, которые существуют в химии. Важно помнить, что основания играют важную роль во многих аспектах нашей жизни, и их разнообразие открывает множество возможностей для исследования и применения в различных областях.
Классификация оснований по свойствам
Реакция с водой
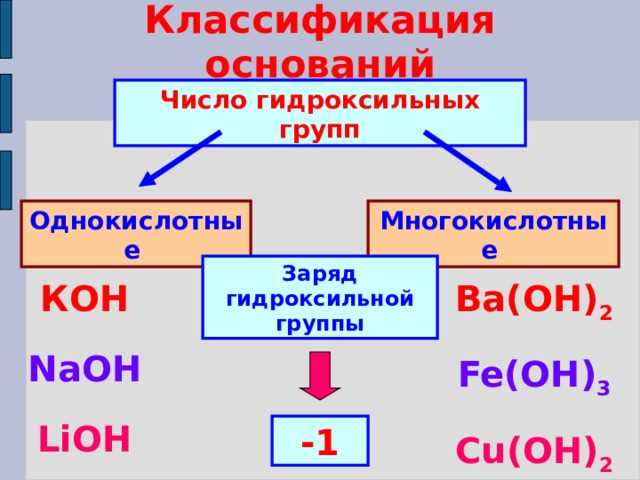
Основания могут быть классифицированы на основе их реакций с водой. Некоторые основания, такие как NaOH (натриевая гидроксид), образуют щелочные растворы, когда растворяются в воде. Щелочные растворы обладают особым свойством – они могут изменить цвет красителя, известного как индикатор pH, и превратить его в щелочную среду. Другие основания, такие как NH3 (аммиак), образуют щелочный раствор и обладают характерным запахом. Реакция с водой – одно из основных свойств оснований, которое позволяет классифицировать их.
Содержание ионов гидроксида
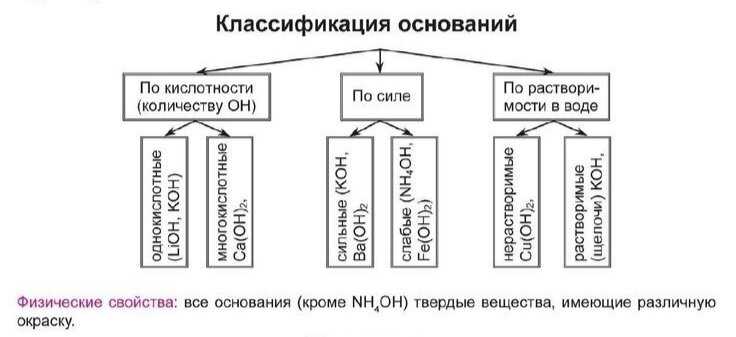
Основания могут быть классифицированы также по содержанию ионов гидроксида (OH-) в их составе. Некоторые основания, например, NaOH, содержат высокую концентрацию ионов гидроксида и образуют сильные основания. Другие основания, такие как Mg(OH)2 (магниевая гидроксид), содержат меньшую концентрацию ионов гидроксида и образуют слабые основания. Различие в концентрации гидроксидных ионов определяет силу основания.
Восстановительная способность
Основания также могут быть классифицированы по своей восстановительной способности. Некоторые основания, например, NaOH, обладают сильной восстановительной способностью и могут принимать электроны от других веществ, вызывая окисление. Другие основания, такие как Ca(OH)2 (кальциевая гидроксид), имеют более слабую восстановительную способность и могут принимать электроны в меньшей степени. Восстановительная способность оснований является ещё одним важным свойством для их классификации.
Таким образом, основания могут быть классифицированы по реакции с водой, содержанию ионов гидроксида и восстановительной способности. Эти характеристики определяют свойства и возможные применения оснований в разных областях. Знание классификации оснований поможет понять их химические свойства и использовать их с максимальной эффективностью. А вы какие основания знаете? Какие из них вы видели в повседневной жизни? Напишите в комментариях!
Реакции оснований
Одной из наиболее распространенных реакций оснований является нейтрализация. При нейтрализации основание реагирует с кислотой, образуя соль и воду. Например, реакция нейтрализации между гидроксидом натрия (NaOH) и хлористоводородной кислотой (HCl) даёт хлорид натрия (NaCl) и воду:
NaOH + HCl → NaCl + H2O
Реакции оснований также могут включать такие процессы, как гидролиз и образование комплексов. Гидролиз возникает, когда основание реагирует с водой, образуя ионы гидроксида и соответствующие ионы соли. Например, гидролиз гидроксида аммония (NH4OH) приводит к образованию иона гидроксида (OH-) и иона аммония (NH4+) в водном растворе:
NH4OH ↔ NH4+ + OH—
Образование комплексов возникает при реакции основания с соединениями, содержащими металлы. В результате образуется комплексный ион, состоящий из основания и металла. Например, реакция гидроксида железа (III) (Fe(OH)3) с хлоридом натрия (NaCl) может привести к образованию соединения [FeCl4]—, где гидроксид железа (III) действует как основание:
Fe(OH)3 + 4NaCl → [FeCl4]— + 3NaOH
Реакции оснований имеют огромное значение в химической промышленности и научных исследованиях. Например, они используются для производства различных соединений, таких как щелочи и медикаменты. Кроме того, реакции оснований играют важную роль в управлении pH растворов и в многих биологических процессах.
Итак, реакции оснований не только интересны с точки зрения науки, но и имеют практическое значение. Они помогают нам понять и использовать химические процессы, которые окружают нас в нашей повседневной жизни.
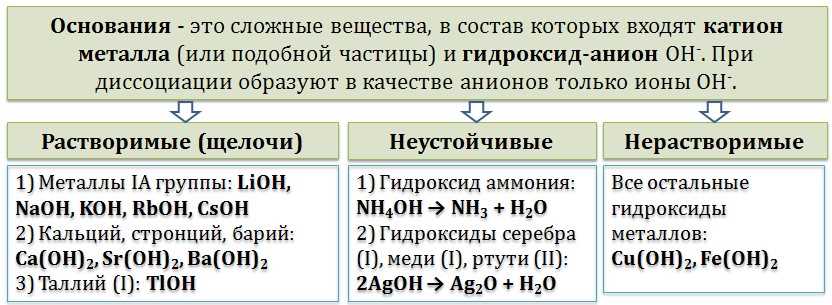
Основания в химии и их классификация
- В растворе они выделяют гидроксид ион OH-
- Они способны принимать протоны (H+) от сильных кислот и образовывать соль и воду
- Они изменяют кислотность раствора, увеличивая его рH и делая его менее кислотным
Основания можно классифицировать по различным признакам:
- По происхождению:
- Естественные основания: образуются в природе, например, гидроксид натрия или гидроксид калия
- Синтетические основания: получаются в результате химических реакций, например, аммиак или гидроксид аммония
- По растворимости:
- Растворимые основания: полностью распадаются в воде, например, гидроксид натрия
- Нерастворимые основания: практически не растворяются в воде, например, оксид кальция
- По степени диссоциации:
- Сильные основания: полностью диссоциируют в растворе, например, гидроксид натрия
- Слабые основания: диссоциируют в растворе только частично, например, аммиак





