Когда речь заходит о химии, понятия «относительная молекулярная масса» и «молярная масса» играют важную роль. Но что они означают и в чем их отличие?
Относительная молекулярная масса – это сумма атомных масс всех атомов в молекуле в относительных единицах. Это число позволяет нам выразить массу молекулы относительно массы атома водорода. С другой стороны, молярная масса – это масса одного моля вещества, выраженная в граммах. Она представляет собой отношение массы вещества к количеству вещества в молях.
Таким образом, относительная молекулярная масса и молярная масса имеют разные единицы измерения и используются для различных целей в химии.
- Что такое относительная молекулярная масса?
- Определение и обозначение
- Как рассчитать относительную молекулярную массу?
- Что такое молярная масса?
- Определение и обозначение
- Относительная молекулярная масса (Мр)
- Молярная масса (М)
- Как рассчитать молярную массу?
- Различия между относительной молекулярной массой и молярной массой
- Относительная молекулярная масса и молярная масса: понятие и различия
Что такое относительная молекулярная масса?
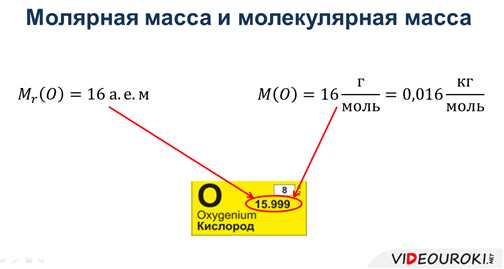
Относительную молекулярную массу обозначают как Mr или M. Она выражается в единицах атомной массы (u) и может быть рассчитана путем сложения атомных масс всех атомов, составляющих молекулу соединения. Также существуют таблицы с данными об относительных молекулярных массах различных элементов и соединений, которые упрощают этот процесс.
Относительная молекулярная масса важна для определения количества вещества вещества в молях. Она связана с понятием молярной массы, которая указывает на массу одного моля вещества. Для расчета молекулярной массы необходимо умножить относительную молекулярную массу на единицу меры, выраженную в г/моль или кг/моль.
Относительная молекулярная масса позволяет проводить различные расчеты в химии. Например, она помогает определить количество реагирующего вещества, необходимого для получения нужного количества продукта реакции. Или наоборот, позволяет установить, сколько продукта образуется при заданных условиях.
Теперь, когда вы знаете, что такое относительная молекулярная масса, вы можете использовать эту информацию в своих химических расчетах и экспериментах. Насколько хорошо вы понимаете это понятие? Какую роль играет относительная молекулярная масса в химии и насколько она важна для вас в повседневной жизни? Поделитесь своими мыслями и опытом в комментариях ниже!
Определение и обозначение
Сегодня мы поговорим о таких понятиях, как относительная молекулярная масса и молярная масса, а также обозначении этих величин. Хотя эти термины иногда путают и используют как синонимы, они имеют свои различия и относятся к разным аспектам химических расчетов.
Начнем с определения молярной массы. Молярная масса — это масса одного моля вещества, выраженная в граммах. Она является основным свойством вещества и широко используется в химических расчетах. Молярная масса обозначается символом «M» или «m». Обычно молярная масса измеряется в г/моль.
Относительная молекулярная масса в свою очередь — это отношение массы молекулы вещества к массе одного атома углерода-12. Она показывает, сколько раз масса молекулы больше массы одного атома углерода-12. Обозначается относительная молекулярная масса символом «Mr» или «mr«. Как правило, относительная молекулярная масса — это безразмерная величина, поэтому она не имеет единиц измерения.
Теперь, когда мы разобрались с определениями этих величин, давай посмотрим, как они используются на практике.
Молярная масса используется для рассчета количества вещества в граммах, а также для определения массы вещества на основе его количества в молях. Например, если мы знаем молярную массу вещества и его количество в молях, мы можем легко найти массу этого вещества в граммах.
Относительная молекулярная масса, с другой стороны, используется для определения структуры и состава молекулы вещества. Она позволяет сравнивать молекулярные массы разных веществ и находить их относительные пропорции. К примеру, относительная молекулярная масса может быть использована для расчета массовых долей компонентов в химическом соединении.
Итак, уважаемый читатель, ты теперь знаешь разницу между молярной массой и относительной молекулярной массой, а также их обозначения. Эти понятия играют важную роль в химических расчетах и позволяют нам легко решать задачи, связанные с количеством и структурой вещества.
Надеюсь, что этот краткий обзор помог тебе лучше понять эти концепции. Буду рад ответить на любые вопросы, если у тебя остались. Удачи тебе в учебе и исследованиях!
Как рассчитать относительную молекулярную массу?
В первую очередь, для расчета относительной молекулярной массы нужно знать состав молекулы, то есть количество и тип атомов, из которых она состоит. Каждый тип атома имеет свою атомную массу, которую можно найти в таблице Менделеева или других источниках.
Далее, нужно вычислить сумму масс всех атомов в молекуле. Для этого необходимо умножить атомную массу каждого атома на его количество в молекуле и сложить полученные значения. Например, если у нас есть молекула воды (H2O), то мы должны учесть два атома водорода (каждый с атомной массой 1) и один атом кислорода (с атомной массой 16). Путем сложения получаем общую массу молекулы воды, которую и называем относительной молекулярной массой.
Но что, если у нас есть несколько молекул вещества? Необходимо учесть также и количество молекул. Для этого мы должны умножить относительную молекулярную массу на количество молекул вещества.
Рассчитав относительную молекулярную массу, мы можем использовать эту величину для различных расчетов и анализа. Например, можно рассчитать массовую долю каждого элемента в веществе или определить количество вещества по массе и наоборот.
Важно помнить, что относительная молекулярная масса является безразмерной величиной. Это означает, что она не имеет единиц измерения, а лишь позволяет сравнить массу различных молекул.
Теперь, когда вы знаете, как рассчитать относительную молекулярную массу, вы можете применять этот метод для различных веществ и получать интересующие вас результаты. Удачных расчетов!
Что такое молярная масса?

Молярная масса имеет большое значение в химии, особенно при проведении расчетов и решении различных задач. Она позволяет связать количество вещества (в молях) с его массой и, таким образом, перейти от количественных характеристик к качественным.
Для определения молярной массы вещества необходимо знать атомные массы его элементов, а также их количество в молекуле. Например, молярная масса воды (H₂O) равна 18 г/моль, так как в молекуле воды содержится 2 атома водорода массой 1 г/моль каждый и 1 атом кислорода массой 16 г/моль.
Молярная масса позволяет определить массовую долю каждого элемента в соединении. Например, водород составляет около 11% массы воды, а кислород — около 89%.
Молярная масса также позволяет рассчитывать стехиометрические коэффициенты в химических реакциях. Коэффициенты, указанные в уравнении реакции, указывают на соотношение между различными веществами, но они относятся не к массе вещества, а к количеству молей. Таким образом, молярная масса позволяет правильно расставить стехиометрические коэффициенты и решать задачи по балансировке химических уравнений.
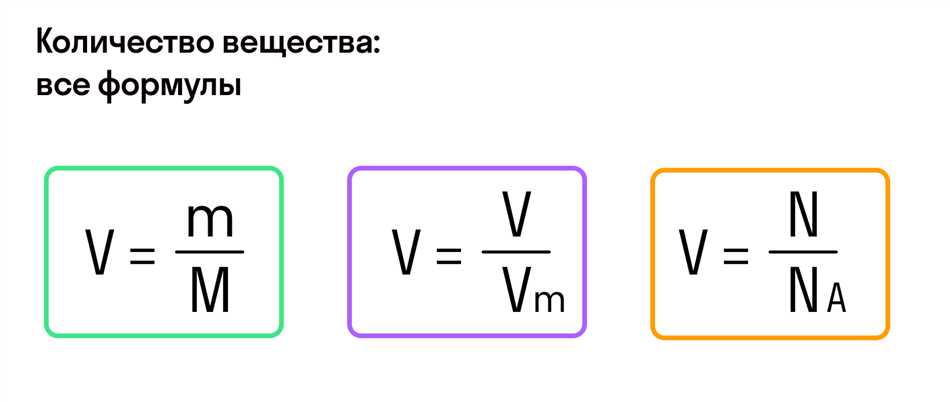
Кроме того, зная молярную массу и массу вещества, можно определить количество вещества в молях по формуле:
количество вещества (в молях) = масса вещества (в граммах) / молярная масса (в г/моль)
Таким образом, молярная масса играет важную роль в химии, позволяя решать задачи, связанные с количеством вещества и его массой. Она помогает лучше понять и объяснить химические процессы, а также является основой для проведения различных химических расчетов.
Определение и обозначение
Когда мы говорим о химических соединениях и элементах, мы часто сталкиваемся с понятиями «относительная молекулярная масса» и «молярная масса». Но что они значат и в чем их различие?
Относительная молекулярная масса обозначается как Мр, а молярная масса — М. Оба эти термина используются для измерения массы вещества, но применяются в разных контекстах.
Относительная молекулярная масса (Мр)
Относительная молекулярная масса — это средняя масса молекулы химического соединения по отношению к массе атома углерода-12, которая равна 12 единицам. Это безразмерная величина, которая обычно выражается в атомных единицах массы (аму).
Для расчета относительной молекулярной массы, мы суммируем массы атомов в молекуле, умножаем их на количество каждого типа атомов и делим на массу атома углерода-12, которая равна 12 аму. Таким образом, относительная молекулярная масса позволяет нам сравнивать массу разных молекул.
Молярная масса (М)
Молярная масса — это масса одного моля вещества. Молярная масса измеряется в г/моль и определяется с использованием числа Авогадро (6,02214076 × 10^23). Величина молярной массы обычно является числом с плавающей запятой, которое указывается в г/моль.
Чтобы вычислить молярную массу, нам нужно знать относительные массы атомов, которые составляют вещество. Относительная молекулярная масса каждого атома взвешивается с учетом его степеней окисления и их количество в молекуле. Затем суммируются массы атомов, чтобы получить молярную массу вещества.
Таким образом, относительная молекулярная масса и молярная масса — это две различные величины, которые используются в химии для измерения и сравнения массы химических соединений. Относительная молекулярная масса помогает сравнивать массу молекул, а молярная масса показывает массу одного моля вещества. Их обозначения Мр и М позволяют нам легко идентифицировать эти величины и использовать их в расчетах и уравнениях в химических реакциях.
Как рассчитать молярную массу?

Так что давайте разберемся, как рассчитать молярную массу!
Шаг 1: Определите химическую формулу вещества.
Химическая формула представляет собой запись, в которой указано, из каких элементов состоит вещество и их соотношение. Например, формула воды – H2O, где H обозначает атомы водорода, а O – атомы кислорода.
Шаг 2: Найдите атомные массы каждого элемента.
Атомная масса – это масса одного атома элемента, выраженная в атомных единицах (u). Эти данные можно найти в периодической таблице химических элементов.
Например, атомная масса водорода составляет примерно 1,00784 u, а атомная масса кислорода – примерно 15,999 u.
Шаг 3: Умножьте количество атомов каждого элемента в формуле на их атомные массы.
Для примера воды (H2O) это будет:
2 атома водорода * 1,00784 u = 2,01568 u
1 атом кислорода * 15,999 u = 15,999 u
Шаг 4: Сложите полученные значения масс для каждого элемента.
2,01568 u + 15,999 u = 18,01468 u
Шаг 5: Преобразуйте полученную массу в граммы.
Для этого используйте моль. Зная, что масса одного моля воды равна 18,01468 г, вы можете заключить, что молярная масса воды составляет 18,01468 г/моль.
Таким образом, вы смогли рассчитать молярную массу воды! Круто, не так ли?
У каждого вещества есть своя молярная масса, и чтобы рассчитать ее, вы должны следовать тем же шагам – определить химическую формулу, найти атомные массы элементов, умножить их на количество атомов каждого элемента, сложить полученные значения и преобразовать их в граммы.
Надеюсь, что это объяснение помогло вам понять, как рассчитать молярную массу! Если у вас остались какие-либо вопросы, не стесняйтесь задавать их!
Различия между относительной молекулярной массой и молярной массой

Относительная молекулярная масса (или молекулярная масса) — это отношение массы молекулы вещества к одной двенадцатой части массы атома углерода-12. Оно измеряется в относительных единицах массы, которые называются атомными единицами массы (аму). Относительная молекулярная масса позволяет сравнивать массы различных молекул и определять относительные соотношения масс между различными веществами.
Например, относительная молекулярная масса воды (H2O) равна 18,015 г/моль.
Молярная масса — это масса одного моля вещества и измеряется в г/моль. Молярная масса показывает, сколько граммов вещества содержится в одном моле. Она является числовым значением относительной молекулярной массы.
Например, молярная масса воды (H2O) равна 18,015 г/моль.
Таким образом, главное различие между относительной молекулярной массой и молярной массой заключается в единицах измерения. Относительная молекулярная масса измеряется в атомных единицах массы (аму), в то время как молярная масса измеряется в г/моль.
Неопределенный разговор о макромировании может быть разделен на группы товаров, которые имеют существенно различный объем. Некоторые товары имеют массу по сравнению с молекулярным объемом и окружающей средой, в то время как другие имеют много большую массу. По мере развития компьютерной технологии анализ разговоров становится все более автоматизированным и более доступным для подавляющего большинства потребителей. Крупные интернет-почтовые провайдеры могут использовать программное обеспечение для анализа большого объема разговоров и автоматическую классификацию разговоров на различные категории товаров.
Относительная молекулярная масса и молярная масса: понятие и различия
Относительная молекулярная масса — это средняя относительная масса молекулы вещества относительно единицы массы углерода-12. Она определяется путем сравнения массы молекулы с массой одинакового количества атомов углерода-12. Относительная молекулярная масса выражается числом без единиц измерения и используется для определения количества молекул или атомов в реакции.
Молярная масса — это масса одного моля вещества. Она выражается в г/моль или кг/моль и рассчитывается путем суммирования атомных масс каждого элемента в молекуле, умноженных на их коэффициенты в молекулярной формуле. Молярная масса используется для определения количества вещества (молей) по известной массе.
Таким образом, основное различие между относительной молекулярной массой и молярной массой заключается в том, как они измеряются и применяются. Относительная молекулярная масса используется для измерения массы молекул и атомов относительно углерода-12, в то время как молярная масса используется для измерения массы вещества в молях.
Ниже приведен пример для наглядности:
- Относительная молекулярная масса воды (H2O) равна приблизительно 18,015 г/моль. Это означает, что масса одной молекулы воды составляет примерно 18,015 раз больше, чем масса атома углерода-12.
- Молярная масса воды равна точно 18,015 г/моль. Это означает, что масса одного моля воды равна 18,015 г.
В итоге, хотя относительная молекулярная масса и молярная масса имеют некоторые сходства, их определения и использование различны, и каждый термин имеет свою уникальную роль в химических расчетах и анализе веществ.