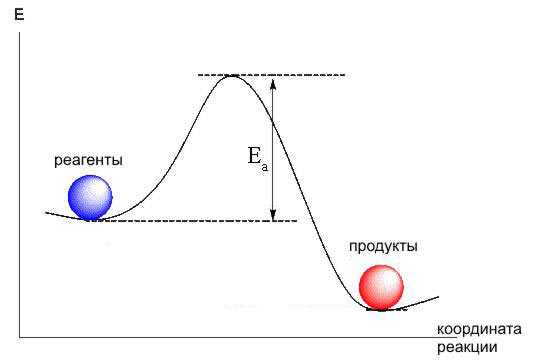
Температура является одним из наиболее значимых факторов, влияющих на скорость химических реакций. Высокая или низкая температура может значительно изменить скорость реакции.
Когда температура повышается, молекулы веществ начинают двигаться быстрее и сталкиваться между собой с большей энергией. Это приводит к увеличению вероятности успешной встречи молекул и, следовательно, ускоряет реакцию.
Кроме того, при повышении температуры энергия активации реакции уменьшается. Энергия активации — это энергия, которую необходимо потратить, чтобы реакция началась. С увеличением температуры, энергия активации снижается, и реакция может происходить при более низкой энергии.
Однако, при низкой температуре, молекулы движутся медленнее и сталкиваются реже. Это означает, что вероятность удачной встречи молекул снижается, и скорость реакции замедляется.
Таким образом, температура играет важную роль в скорости химических реакций, регулируя скорость столкновений молекул и энергию, необходимую для начала реакции.
Лежащие в основе химических реакций принципы
Волшебство химических реакций происходит на микроскопическом уровне, где атомы и молекулы достигают совершенства своей хаотичной танцевальной магии. Это так круто! Но что на самом деле происходит?
В основе химических реакций лежат несколько принципов, которые всегда стоят на страже этого впечатляющего шоу. Один из них — закон сохранения массы. Просто представь себе: ни одна атомная вечеринка не может обойтись без соблюдения этого закона. Все атомы и молекулы просто перетанцовываются, не рождая и не исчезая.
Другой принцип — это закон сохранения энергии. Помнишь, как ты двигался по танцполу? Ты потреблял энергию и выделял ее в процессе движения. Точно так же и атомы и молекулы тратят и выделяют энергию при своих перетанцовках.
И самое интересное, что эти два принципа слиты воедино. Генерация или потребление энергии не нарушают закон сохранения массы, а, наоборот, всегда остаются в равновесии.
Когда химическая реакция происходит, атомы и молекулы испытывают ажиотаж. Они ведут себя, словно на свидании. И, знаешь, что может привлечь двух атомов или молекулу друг к другу? Их структура, их заряды, их энергия или их настроение? Все это! Они притягиваются к себе, танцуют в такт и, наконец, образуют новые связи и продукты реакции. И все это благодаря принципу химической энергии!
Интересно, чем закончится эта вечеринка? Что случится с атомами и молекулами? Какой будет конечный продукт? Столько вопросов и только один способ найти ответы: углубиться в удивительный мир химии и ощутить реакции собственными руками!
Реакционная скорость и ее определение
Чтобы определить реакционную скорость, следует измерить изменение концентрации реагентов или продуктов реакции в течение некоторого времени. А можно ли представить себе химическую реакцию, которая происходит настолько быстро, что невозможно измерить ее скорость? Или наоборот, реакция, которая так медленно протекает, что изменение концентрации практически не заметно? Подумайте!
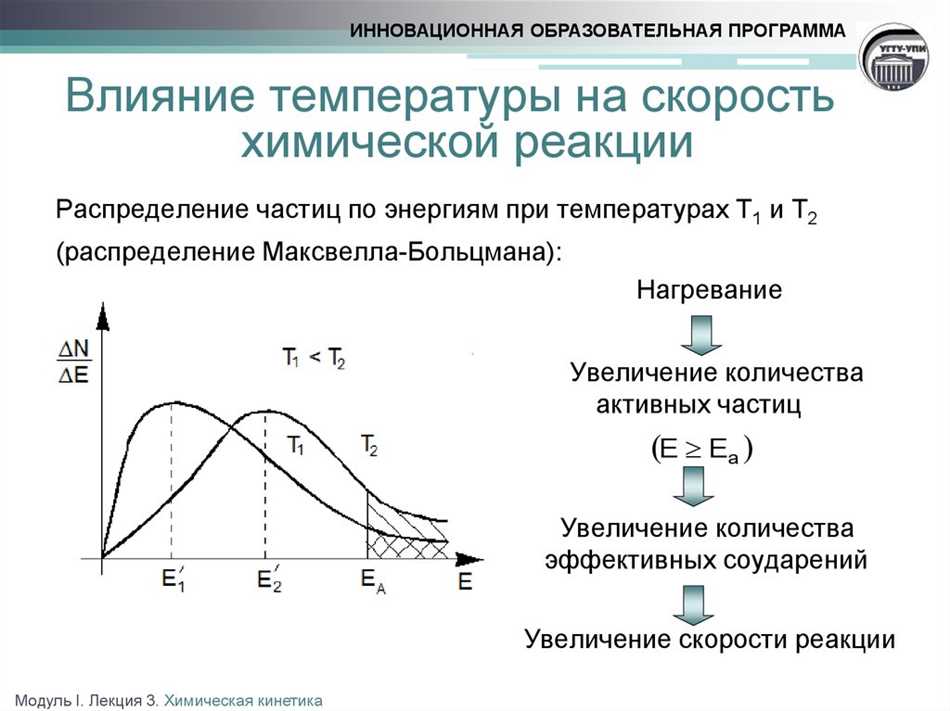
Также важными факторами, влияющими на реакционную скорость, являются концентрация реагентов, температура, давление и катализаторы. Интересно, правда? Например, повышение температуры обычно ускоряет реакцию, так как это увеличивает энергию частиц и их столкновения, что способствует большему количеству успешных соударений. Замечательно, как маленькие детали могут так сильно влиять на химические процессы!
Реакционная скорость – это удивительное понятие, которое помогает нам понять и контролировать химические реакции. Иногда она может быть быстрой и энергичной, иногда медленной и тихой. Но всегда это одно из самых интересных свойств химии.
Влияние активированной энергии на скорость реакции
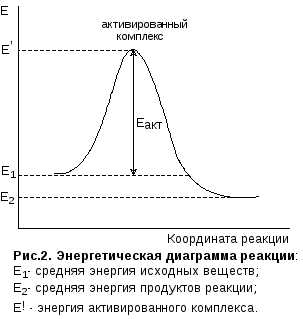
Вот представь: молекулы как будто играют в прыжки через яму. Когда энергия повышается, эти прыжки становятся больше и более энергичными. Большая активированная энергия означает, что прыжки через яму становятся легче, и реакция проходит быстрее. Меньшая энергия означает, что молекулы делают менее энергичные прыжки, и реакция идет медленнее.
И теперь, давай подумаем о температуре. Когда мы повышаем температуру, мы увеличиваем количество энергичных молекул и скорость их движения. Это означает, что больше молекул сможет преодолеть активированную энергию и совершить прыжок через энергетический барьер. В результате, скорость реакции увеличивается!
Так что, если хочешь ускорить химическую реакцию, просто повысьтем пературу! Вот такой вот интересный способ влиять на активированную энергию и скорость реакции. Что думаешь об этом?
Кинетическая теория и ее связь с химическими реакциями
В Кинетической теории говорится, что при повышении температуры, молекулы движутся быстрее и их энергия увеличивается. Когда молекулы имеют высокую энергию, они сталкиваются чаще и с большей силой, что повышает вероятность успешной реакции. С другой стороны, при низких температурах, движение молекул замедляется, и вероятность успешной реакции снижается.
Таким образом, температура играет решающую роль в химических реакциях. Она может ускорить или замедлить их, в зависимости от ее значения. Например, при повышении температуры пищи, мы ускоряем химические реакции внутри нашего организма, что помогает эффективнее усваивать пищу.
Так что помни: когда дело доходит до химических реакций, температура – это ключевой фактор, влияющий на их скорость. Поддерживай тепло и пойми, что все вокруг нас постоянно движется и изменяется, словно маленькие частицы мира, которые объединяются и преображаются во что-то новое.
Основные принципы кинетической теории
Первый принцип кинетической теории — все вещества состоят из молекул или атомов, которые постоянно движутся. Это движение может быть как прямолинейным, так и хаотичным. На самом деле, если мы могли увидеть эти молекулы, они бы казались нам маленькими шариками, которые непрерывно беспорядочно толкаются и отскакивают друг от друга.
Второй принцип — энергия частиц зависит от их скорости. Чем выше скорость частицы, тем больше ее энергия. Это объясняет, почему нагретые предметы имеют большую энергию, чем охлажденные. Когда предмет нагревается, молекулы начинают двигаться быстрее, что приводит к более интенсивным реакциям.
Третий принцип — силы, действующие на частицы, могут изменить их движение. Это означает, что когда две частицы сталкиваются, они взаимодействуют и при этом могут менять направление или скорость своего движения.
Кинетическая теория играет ключевую роль в понимании химических реакций, поскольку помогает объяснить, почему они происходят с различной скоростью при разных температурах. При повышении температуры, молекулы двигаются быстрее, и это приводит к более частым столкновениям молекул, что способствует более активным химическим реакциям.
Итак, кинетическая теория является фундаментальной для объяснения поведения и взаимодействия частиц. Она помогает нам понять, почему все вокруг нас находится в постоянном движении и как температура влияет на химические реакции. Это фантастическое путешествие в мир непрерывного движения и энергии!
Столкновения молекул и скорость реакций
Знаешь ли ты, что скорость химических реакций зависит от температуры? Все дело в столкновениях молекул! Да, да, они играют ключевую роль в определении скорости реакции.
Представь себе, что молекулы реагирующих веществ в растворе или газообразном состоянии постоянно двигаются, вибрируют и встречаются друг с другом. Эти столкновения дают толчок для начала реакции. Чем они сильнее и чаще, тем быстрее происходит реакция.
Теперь представь себе, что ты сплавляешься на горке летом и зимой. Как думаешь, на каком участке скорость движения будет выше? Конечно же, зимой! Ведь молекулы, подобно тебе на горке, при низкой температуре двигаются медленнее и сталкиваются реже. А вот летом, когда температура повышается, молекулы начинают двигаться быстрее и попадаются друг другу чаще.
И не только скорость столкновений важна! Когда температура растет, молекулы становятся более энергичными и их силы столкновений возрастают. Это может привести к тому, что при столкновении они легче преодолеют барьер энергии активации и реакция произойдет быстрее.
Вот так, дорогой друг, температура играет важную роль в скорости химических реакций. Возможно, ты заметил это в повседневной жизни: варишь воду для чая или жаришь яичницу — все это примеры химических реакций, которые происходят быстрее, когда повышается температура.


