Когда мы говорим о том, что атомы одного и того же элемента могут иметь разное количество нейтронов, мы заходим в мир изотопов. Изотопы – это атомы, которые имеют одинаковое количество протонов в ядре, но отличаются по числу нейтронов. В физике изотопы играют важную роль, так как их свойства могут отличаться друг от друга, что имеет влияние на химические и физические процессы. Знать и понимать основные понятия и характеристики изотопов поможет нам лучше понять мир атомов и его законы.
Основные понятия и характеристики изотопов
Давайте поговорим о изотопах! В физике этот термин обозначает разновидности атомов, которые имеют одинаковое количество протонов, но разное количество нейтронов в ядре. Изотопы могут быть стабильными или нестабильными, что влияет на их свойства и химическую активность.
Стабильные изотопы:
- Имеют длительное время полураспада или не подвержены полураспаду вообще;
- Не имеют способности к радиоактивному излучению;
- Часто встречаются в природе в больших количествах;
- Применяются в различных областях, включая медицину и археологию.
Нестабильные изотопы:
- Имеют короткое время полураспада и подвержены радиоактивному распаду;
- Излучают радиоактивное излучение в форме альфа-, бета- и гамма-лучей;
- Могут использоваться в медицине для диагностики и лечения рака;
- Имеют важное значение в исследованиях искусственных изотопов и ядерных реакций.
Когда мы говорим о характеристиках изотопов, в первую очередь обращаем внимание на их атомную массу. Атомная масса изотопа определяется как средневзвешенное значение массы всех его изотопов с учетом их относительной распространенности в природе. Атомная масса обозначается в атомных единицах (аму) и является важным показателем в химии и физике.
Кроме того, изотопы имеют различное количество нейтронов в ядре, что отражается на их ядерных свойствах. Например, некоторые изотопы могут быть расщеплены под действием нейтронов и использоваться в ядерной энергетике в качестве топлива для атомных реакторов. Другие изотопы могут быть использованы в радиоизотопной терапии для лечения рака или в качестве метки для исследований в медицине и биологии.
Таким образом, изотопы играют важную роль в нашей жизни, открывая новые возможности для научных исследований и практического применения. Они помогают нам лучше понять и изучать мир вокруг нас, а также применять полученные знания для решения различных задач и проблем.
Изотопы: определение и основные свойства
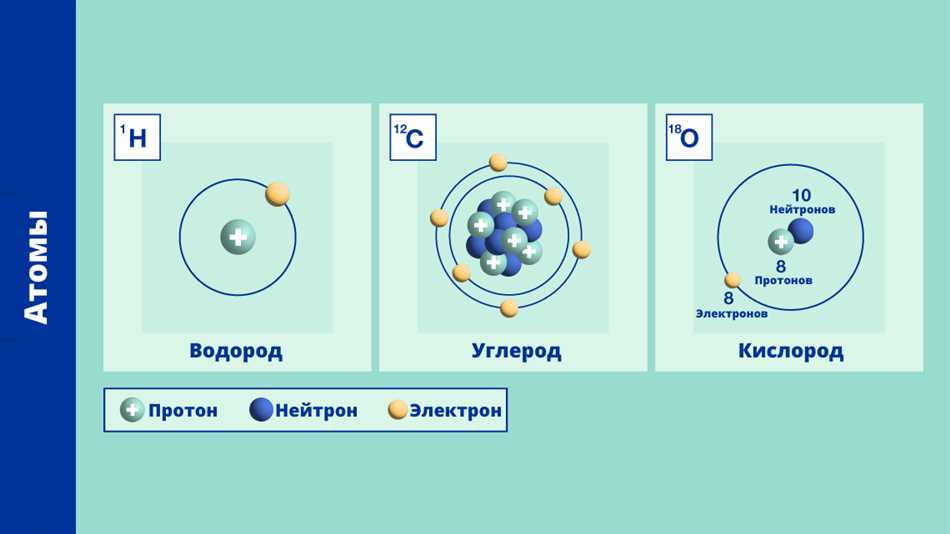
Основными свойствами изотопов являются их массовое число и атомная масса. Массовое число определяется суммой протонов и нейтронов в ядре атома. Атомная масса — это средневзвешенное значение массовых чисел всех изотопов данного элемента, учитывая их относительную частоту в природе.
Одним из важных свойств изотопов является их стабильность или нестабильность. Некоторые изотопы являются стабильными и не претерпевают радиоактивного распада со временем, в то время как другие изотопы являются нестабильными и подвергаются радиоактивному распаду. Это свойство нестабильных изотопов используется в радиоактивных препаратах и при проведении радиоуглеродного анализа для определения возраста археологических и геологических объектов.
Кроме того, изотопы могут иметь разные химические свойства. Это связано с тем, что разное число нейтронов в ядре может влиять на его структуру и взаимодействие с другими атомами. Например, изотопы углерода — углерод-12, углерод-13 и углерод-14 — имеют различные пропорции изотопов в природе и могут образовывать разные химические соединения.
Изотопы широко используются в научных исследованиях, медицине, промышленности и энергетике. Например, изотопы используются в радиоизотопной диагностике и лечении рака, в процессе синтеза новых материалов и в производстве электричества в ядерных электростанциях.
Изомеры и их роль в изучении изотопов
В изотопах существуют два типа изомеров — ядра с одинаковым количеством протонов и нейтронов, но с разными энергетическими состояниями. Они могут быть в основном или возбужденном состоянии. Основные изомеры являются стабильными и длительно существуют, в то время как возбужденные изомеры нестабильны и быстро распадаются, излучая энергию в виде фотонов или частиц.
Изомеры играют важную роль в изучении изотопов. Они позволяют исследователям получить дополнительную информацию о структуре и свойствах ядерных изотопов. Сравнение различных изомеров позволяет установить зависимость энергетического состояния атомов от их структуры и массы. Это позволяет провести более точные измерения свойств изотопов и использовать их в различных областях науки и технологий.
Кроме того, изомеры являются важными инструментами для исследования и контроля ядерных реакций. Они могут быть использованы для повышения эффективности ядерных реакторов, создания новых радиоактивных препаратов для медицинского применения и даже для создания новых методов энергетической генерации.
Изомеры также находят применение в радиоизотопной датировке и исследованиях окружающей среды. Изучение изотопического состава геологических образцов и атмосферных отложений позволяет получить информацию о возрасте и происхождении различных геологических формаций и изменениях климата на протяжении миллионов лет.
Способы образования изотопов и их классификация
Способы образования изотопов
Существует несколько способов образования изотопов. Один из них — радиоактивный распад, при котором ядро нестабильного изотопа устремляется к более стабильной форме путем испускания частиц или энергии. Этот процесс может быть естественным или искусственно созданным.
Другой способ образования изотопов — ядерные реакции. В ядерных реакциях происходит изменение состава ядра атома под воздействием другого ядра или частицы. Такие реакции могут происходить в природе или быть искусственно созданными в лабораторных условиях.
Также изотопы могут образовываться в процессе ядерного синтеза, который происходит в звездах, включая наше Солнце. В результате ядерного синтеза происходит объединение легких ядер в более тяжелые, а это приводит к образованию изотопов.
Классификация изотопов
Изотопы могут быть разделены на стабильные и нестабильные. Стабильные изотопы не подвержены радиоактивному распаду и остаются стабильными в течение очень длительного времени. Нестабильные изотопы имеют неустойчивую структуру ядра и подвержены радиоактивному распаду с течением времени.
Кроме того, изотопы могут быть классифицированы по их массовому числу, которое представляет собой сумму протонов и нейтронов в ядре атома. Изотопы с одинаковым числом протонов, но разным числом нейтронов, называются изотопами одного элемента.
Некоторые изотопы имеют особое значение в науке и технологии. Например, уран-235 используется в ядерной энергетике, а углерод-14 используется для определения возраста археологических находок.
Изучение изотопов позволяет нам лучше понять свойства и процессы, происходящие в мире вокруг нас. Благодаря характеристикам изотопов мы можем узнать о происхождении вещества, его возрасте и многом другом.
Изотопы в физике: основные понятия и характеристики
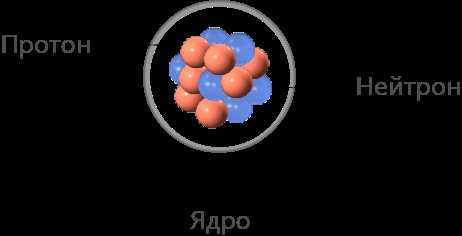
Каждый изотоп обладает своей уникальной массой из-за различного числа нейтронов. Например, самый распространенный углерод имеет 6 протонов и 6 нейтронов в ядре, образуя изотоп C-12, но также существуют изотопы углерода с числом нейтронов отличным от 6, например C-13 и C-14.
Основными характеристиками изотопов являются массовое число и атомный номер. Массовое число определяется суммой протонов и нейтронов в ядре. Атомный номер равен числу протонов и определяет положение элемента в таблице Менделеева.
Изотопы могут иметь разные стабильности, а также различаться химическими свойствами. Некоторые изотопы являются радиоактивными и распадаются со временем, испуская радиацию. Изотопы также используются в различных областях науки и технологий, например, в медицине для диагностики и лечения, а также в археологии и геологии для определения возраста материалов.
- Массовое число: сумма протонов и нейтронов в ядре.
- Атомный номер: число протонов в ядре.
- Радиоактивность: способность изотопа распадаться со временем.
- Изотопный состав: соотношение различных изотопов в образце.
- Использование: медицина, археология, геология и другие научные и промышленные области.
Изотопы играют важную роль в понимании структуры атома и являются важными инструментами в научных исследованиях и практическом применении в различных областях.