Оксиды – это класс веществ, который широко используется в химии и имеет множество разнообразных свойств. Оксиды образуются путем соединения элементов с кислородом. Эти соединения могут быть простыми (содержащими только один элемент) или сложными (содержащими несколько элементов).
Свойства оксидов могут варьироваться в зависимости от состава и структуры вещества. Некоторые оксиды являются кислотами или основаниями, способными реагировать с другими соединениями. Некоторые оксиды являются проводниками электричества, в то время как другие оксиды являются непроводниками.
В этой статье мы рассмотрим основные свойства оксидов и их применение в различных областях, начиная от промышленности до медицины.
Определение оксида
Ты когда-нибудь слышал о химическом соединении, называемом оксидом? Если нет, то не переживай, я тебе расскажу все об этом интересном веществе. Так что давай начнем!
Оксид — это химическое соединение, состоящее из атомов кислорода и других элементов. Интересно, что слово «оксид» происходит от греческого слова «οξυς» (oxy), что означает «кислород», и «οξειν» (ozen), что означает «обеднять». Таким образом, оксиды являются соединениями, в которых кислород «обедняет» другие элементы.
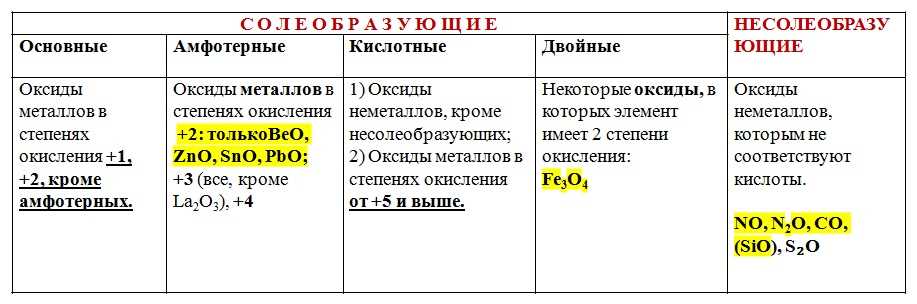
Оксиды имеют разнообразные свойства и могут быть как кислотными, так и основными. Кислотные оксиды образуют кислоты при растворении в воде, в то время как основные оксиды образуют основания. Кроме того, некоторые оксиды являются амфотерными, то есть они могут проявлять как кислотные, так и основные свойства в зависимости от условий.
Оксиды также могут иметь различные физические свойства. Некоторые оксиды являются твердыми веществами, такими как диоксид кремния (SiO2), который является основным компонентом песка. Другие оксиды, например, оксиды некоторых металлов, могут быть газообразными или жидкими при комнатной температуре.
Одним из самых распространенных и известных оксидов является оксид железа, также известный как ржавчина. Ты, наверняка, видел его на старых металлических предметах, которые просто не могут не ржаветь со временем.
Теперь, когда ты знаешь, что такое оксид, тебе будет интереснее изучать химию и понимать, как эти соединения взаимодействуют с другими веществами. Помни, что оксиды играют важную роль в природе и в нашей повседневной жизни!
Структура оксида
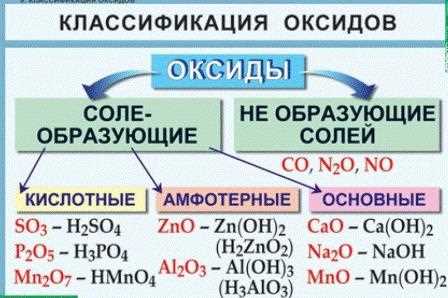
Когда атомы кислорода соединяются с другими элементами, они образуют различные оксиды. Структура оксида определяется такими факторами, как валентность атома кислорода и совместимость его электронной конфигурации с атомами других элементов. В результате могут образовываться различные типы связей и кристаллических решеток.
Некоторые оксиды имеют простую структуру. Например, оксид натрия (Na2O) имеет ионную структуру, где ионы натрия (Na+) расположены в кристаллической решетке, а ионы кислорода (O2-) окружают их. Это приводит к образованию кристаллической сетки с определенным порядком и пространственной структурой.
Другие оксиды, например, оксид кремния (SiO2), образуют сети с координационной связью. Атомы кислорода окружают атомы кремния таким образом, что каждый атом кислорода связан с двумя или четырьмя атомами кремния. Это создает трехмерную сетку с кварцевой структурой.
Структура оксидов влияет на их свойства. Например, ионные оксиды обычно растворяются в воде, образуя растворы с щелочной реакцией. С другой стороны, координационные оксиды обычно не растворяются в воде и имеют кислотные или амфотерные свойства.
Структура оксида также может влиять на его теплопроводность, электропроводность и механическую прочность. Это связано с особенностями взаимодействия атомов в кристаллической решетке и соседних связей.
Значение структуры оксидов в химии и науке не может быть переоценено. Она является основой для понимания их свойств, реакций и применений. Понимание структуры оксидов помогает нам разрабатывать новые материалы и прогрессировать в области химических исследований.
Основные свойства оксида
1. Химическая активность:
Оксиды обладают высокой химической активностью, что означает, что они легко взаимодействуют с другими веществами. Они могут реагировать с водой, кислотами и щелочами, что может привести к образованию новых соединений. Например, когда дышим, наши легкие взаимодействуют с кислородом, образуя оксид углерода и воду. Эта реакция очень важна для процесса дыхания.
2. Физические свойства:
Оксиды имеют различные физические свойства в зависимости от их состава и структуры. Некоторые оксиды могут быть кристаллическими соединениями, тогда как другие — аморфными. Они могут быть твердыми, жидкими или газообразными при обычных условиях.
3. Окислительные свойства:
Многие оксиды обладают окислительными свойствами. Это означает, что они могут отбирать электроны у других веществ, что приводит к окислению этих веществ. Например, оксид железа может окислить алюминий и вызвать ржавчину на его поверхности.
4. Кислотно-щелочные свойства:
Некоторые оксиды проявляют кислотно-щелочные свойства. Это означает, что они могут реагировать с водой и образовывать кислоты или щелочные растворы. К примеру, оксид кальция реагирует с водой, образуя щелочный раствор — гашеную известь, который широко используется в строительстве.
5. Физиологическое значение:
Оксиды играют важную роль в организмах живых существ. Например, оксид азота является сигнальным молекулом в организме, регулирующим множество биологических процессов. Кроме того, оксид кальция необходим для костей и зубов, а оксид железа играет ключевую роль в передаче кислорода в крови.
- Оксиды имеют широкий спектр свойств и приложений, что делает их важными для многих отраслей науки и промышленности.
- Вы довольны этой информацией? Расскажите, что вы знаете об оксидах и их свойствах!
Физические свойства оксида
Одним из наиболее известных оксидов является оксид железа, также известный как ржавчина. Он обладает темно-красной оттенком, который является результатом вмешательства окружающей среды. Кроме того, оксид железа имеет магнитные свойства, что делает его полезным для изготовления радиопередатчиков и динамиков.
Оксид алюминия, известный также как глинистый кирпич, имеет белый цвет и является одним из наиболее распространенных оксидов. Он обладает высокой степенью твердости и стабильностью при высоких температурах, поэтому широко используется в производстве керамики, посуды и строительных материалов.
Еще одним примером оксида является оксид кремния, который обычно встречается в виде кварца или песчаника. Оксид кремния отличается высокой степенью прозрачности для видимого света и устойчивостью к химическим воздействиям. На его основе производят стекло и стеклокерамику, которые находят широкое применение в различных отраслях, включая электронику, строительство и автомобильную промышленность.
Каждый оксид имеет свои уникальные физические свойства, которые делают их полезными и значимыми в нашей повседневной жизни. Некоторые оксиды обладают электрическими или магнитными свойствами, другие обладают оптической прозрачностью или стойкостью к высоким температурам.
Оксиды можно найти во многих предметах, с которыми мы сталкиваемся ежедневно. Как пример, металлические предметы, как кастрюли или столовые приборы, в основном содержат оксиды железа или хрома для защиты от ржавчины. Кроме того, оксиды находят применение в производстве косметики, лекарственных препаратов, катализаторов и даже в космической технологии.
Таким образом, физические свойства оксидов не только обогащают нашу жизнь, но и играют важную роль в нашей технологической и научной деятельности. Оксиды представляют собой уникальные соединения, которые способны влиять на нашу окружающую среду и улучшать качество нашей жизни.
Химические свойства оксида
Одно из важнейших свойств оксидов — их реакционная активность. Оксиды могут образовываться как побочные продукты химических реакций, так и природным образом. Взаимодействуя с другими веществами, оксиды могут претерпевать различные химические реакции, включая окисление, восстановление, гидратацию и дегидратацию. Помимо этого, они могут также вступать в реакции образования новых соединений, обладающих различными свойствами.
Одно из самых известных свойств оксидов — их способность образовывать кислоты при контакте с водой. Например, углеродный оксид (CO2) реагирует с водой, образуя угольную кислоту (H2CO3). Это свойство делает оксиды важными для поддержания кислотно-щелочного баланса в природных системах и помогает регулировать pH-уровень в биологических организмах.
Некоторые оксиды также обладают способностью образовывать ионные соединения. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH). Это является основанием для использования оксидов в качестве основных катализаторов, креозотов и других веществ, которые имеют важное значение для различных процессов и производств.
Оксиды также имеют определенные свойства светоотражения и светопропускания. Некоторые оксиды, такие как диоксид титана (TiO2), обладают высокой оптической прозрачностью и используются в производстве стекол и лакокрасочных материалов. Другие оксиды, такие как оксид цинка (ZnO), имеют светоотражающие свойства и используются в производстве косметических средств и солнцезащитных кремов.
Важно отметить, что каждый оксид имеет свои уникальные химические свойства, которые могут быть использованы в различных целях. Некоторые оксиды имеют сильные окислительные свойства и могут использоваться в процессе сжигания или синтеза веществ. Другие оксиды могут быть использованы в производстве электроники или катализаторов.
В завершение, оксиды — это удивительный класс соединений, который обладает уникальными химическими свойствами. Их способность реагировать с другими веществами, образовывать кислоты и основания, а также их оптические свойства делают их востребованными и интересными для исследований и применений в различных сферах науки и промышленности.
Оксид в химии: что это такое и какие свойства имеет
Оксиды обладают рядом основных свойств, которые делают их важными для различных применений:
- Свойства оксидов вещества: Они часто обладают высокой температурной устойчивостью и могут быть как кислотными, так и щелочными. Оксиды различных элементов могут иметь различные физические свойства: быть твёрдыми, жидкими или газообразными.
- Реактивность оксидов: Оксиды могут претерпевать различные химические реакции, такие как реакции окисления и восстановления.
- Применение оксидов: Оксиды используются в различных отраслях, включая металлургию, электронику, строительство и многое другое. Например, оксиды металлов широко используются в производстве керамики и стекла, а оксиды полупроводников играют важную роль в электронной промышленности.
Примеры оксидов:
| Название оксида | Формула |
|---|---|
| Оксид алюминия | Al2O3 |
| Оксид углерода | CO |
| Оксид кальция | CaO |
| Оксид железа(III) | Fe2O3 |
Это лишь несколько примеров оксидов, существует множество других соединений оксидов с различными элементами и формулами.